
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Виробництво кольорових металів
На сучасному етапі розвитку науково-технічного прогресу неможливо обійтися без кольорових металів, які є незамінними в машинобудуванні й особливо широко використовуються в таких його галузях, як електронна, електротехнічна, радіотелевізійна, приладобудівна та ін.
В Україні кольорова металургія почала швидко розвиватися в радянський період у зв’язку з інтенсивним розвитком енергетики й машинобудування.
У повоєнні роки були розвідані й почалося промислове освоєння родовищ руд важливих кольорових і рідкісних металів та їх виробництво. Разом із тим Україна залишалась масштабним імпортером кольорових металів.
В Україні відкриті й розробляються родовища сировинних ресурсів – алюмінію, магнію, руд титану, цирконію, нікелю, ртуті тощо.
Головними родовищами калійно-магнієвих солей в Україні є Стебниківське й Калуське в Прикарпатті та сполук магнію – Сиваське в Криму.
В Україні відкрито цілий ряд родовищ нікелю, але всі вони дрібні за величиною запасів. Найбільшими з них, які мають промислове значення, є Побузьке й Придніпровське. Найбільші родовища титанових руд знаходяться в Житомирській (Іршанське й Стремигородське) областях і Дніпропетровській (Самотканське). Основні родовища хромітів на Україні відкриті в Кіровоградській і Дніпропетровській областях, але вони ще не експлуатуються. Потреба України в хромі задовольняється його імпортом з Уралу та Казахстану. Руди цирконію в Україні відкриті в Самотканському родовищі титанових руд, також вони є в Приазов’ї. В Україні є значні запаси ртуті. Основне її родовище – Микитівське, яке розташоване в межах м. Горлівки. Родовища ртуті є також у Закарпатті та Криму. Родовища з промисловими запасами молібдену, свинцю і цинку в Україні відсутні, а підвищені концентрації ванадію є тільки в Керченських залізних рудах, які можуть бути основною сировиною для його отримання. У Дніпропетровській, Кіровоградській, Донецькій і Закарпатській областях відкриті родовища золота й ведеться підготовка до їх експлуатації. Самостійні родовища ніобію і гафнію відсутні. Ці метали зустрічаються тільки в комплексних рудах з іншими металами.
Розвиток кольорової металургії як галузі металургійного комплексу почався з уведенням у дію в 1933 р. алюмінієвого, а в 1936 р. – магнієвого заводу в Запоріжжі, а також з організації виробництва цинку в м. Костянтинівці (Донецька обл.). За випуском продукції кольорової металургії Україна займала третє місце в колишньому Радянському Союзі після Російської Федерації і Казахстану.
Комплекс підприємств цієї галузі в Україні здійснює видобуток, збагачення і металургійну переробку руд кольорових і рідкісних металів. До його складу входить виробництво сплавів, прокат кольорових металів і переробка вторинної сировини.
Розміщення підприємств кольорової металургії зумовлене переважно двома основними факторами – сировинним і енергетичним. Підприємства, які переробляють руди з незначним умістом основного металу, тяжіють до джерел сировини (виплавка ртуті, нікелю, рідкісних металів та ін.) Енергомісткі виробництва (титано-магнієве, цинкове, алюмінієве) розміщуються в місцях дешевої електроенергії, як правило, поблизу потужних електростанцій.
У розміщенні підприємств кольорової металургії в Україні виділяються два основні райони: Донецький і Придніпровський.
На території Донецького району знаходиться Микитівський ртутний комбінат, який включає завод, рудники й збагачувальну фабрику. Це підприємство дає понад 90 % продукції СНД. У цьому районі знаходяться Костянтинівський цинковий завод «Укрцинк», який працює на імпортній сировині з Північної Осетії та Західного Сибіру. Розміщено цей завод з орієнтацією на енергетичну базу Донбасу. В Артемівську працює завод з обробки кольорових металів, який випускає латунь, латунний і мідний прокат. Мідь і свинець імпортується з Російської Федерації. У м. Свердловську знаходиться завод алюмінієвого прокату. Придніпровський район кольорової металургії спирається на потужну енергетичну базу, яку утворюють Дніпрогес, теплові й атомні електростанції. У Запоріжжі зосереджені титано-магнієвий і алюмінієвий заводи. Титано-магнієвий завод одержує магнієву сировину з Калуша, Стебника й Сиваша, а титанову – з Іршанського й Самотканського родовищ. Алюмінієвий завод працює на імпортних бокситах з Уралу та інших територій зарубіжних країн. Для виробництва глинозему, яким забезпечується Запорізький алюмінієвий завод, біля Миколаєва побудовано великий глиноземний завод.
У Вольногорську поблизу Дніпродзержинської ГЕС знаходиться Верхньодніпровський гірничо-металургійний комбінат, який працює на титано-цирконієвих рудах Самотканського родовища, а в місті Світловодську, біля Кременчуцької ГЕС, діють завод чистих металів і завод твердих сплавів.
У Кіровоградській області на базі нещодавно відкритого родовища нікелевої руди діє Побузький нікелевий завод. Для забезпечення заводу паливом використовується донецьке коксівне вугілля і електроенергія Південно-Української атомної електростанції. Виробництво магнію здійснюється також Калуським ВО «Хлорвініл».
Україна має тісні економічні зв’язки з іншими країнами СНД із забезпечення її потреб у кольорових металах. Так, з Російської Федерації надходять мідь та її сплави, цинкові концентрати, олово, дорогоцінні метали, з Узбекистану – мідь, з Казахстану – свинець і мідь, з Киргизії – сурма.
Алюміній – легкий, порівняно міцний метал, що має значне поширення. У зв’язку із широким використанням його назвали «крилатим металом». Він застосовується в усіх галузях народного господарства й має велике майбутнє.
Як сировину для виробництва алюмінію можна використовувати боксити, алуніти, сієніти, нефеліни, а також каолін, запаси якого на території України дуже великі. Основною алюмінієвою рудою, на якій базується майже вся світова алюмінієва промисловість, є боксити. Запаси бокситів на території України незначні. Промислове значення мають родовища Смілянське (Черкаська обл.) і Високопільське (Дніпропетровська обл.). Вони в змозі забезпечити сировиною Запорізький алюмінієвий завод протягом певного часу, але їхніх запасів недостатньо для збільшення виробництва алюмінію в Україні. Родовища бокситів відкриті, але до кінця не розвідані на півдні Дніпропетровської області, у Приазов’ї, Карпатах. Цінною сировиною для виробництва алюмінію є алуніти. Значні запаси їх відкриті в Закарпатській області (родовища Берегівське, Беганське). Нефелінові сієніти як сировина для виробництва алюмінію є в Приазов’ї і Дніпропетровській області. Дуже важливою сировиною для виробництва алюмінію є каолін. Його родовища є в багатьох областях України, а видобувається він переважно у Вінницькій, Хмельницькій, Дніпропетровській і Запорізькій областях.
Алюміній (Al) (рос. алюминий, англ. aluminium, нім. Aluminium) – хімічний елемент III групи періодичної системи, його атомний номер 13, відносна атомна маса – 26,9815. У природі існує єдиний стабільний ізотоп 27Al. Третій за вмістом елемент (і найпоширеніший метал) земної кори, що становить приблизно 8 % від її маси.
Назва алюміній походить від слова alumen (галун), яке у свою чергу виникло за Ісідором (VII ст. до н. е.), у зв’язку із застосуванням цієї речовини як протрави для фарбування: «Alumen vocatur a lumin e, quod lumen coloribus praestat tingendis». Пліній описує галуни та їхнє затосування і знаходить згадку про них ще в Геродота (V ст. до н. е.) під назвою σττπτηρία. Однак у той час галуни (тобто KAl(SO4)2·12H2O) не відрізняли від сполук, діючих аналогічно до них наприклад залізного купоросу. У чистому вигляді галуни були отримані, очевидно, алхіміками. Земля, яка була в основі галунів, тобто оксид алюмінію, була вперше отримана в 1754 р. Маргграфом, і пізніше отримала назву глинозем.
Гемфрі Деві в 1808 р. визначив існування металу основи галунів, і назвав його алюміум, а пізніше алюмінум. Протягом 1808–1810 рр. він намагався електролітично виділити цей метал із глинозему, проте це йому не вдалось.
Уперше отримати металевий алюміній вдалося датському фізику Гансу Крістіану Ерстеду в 1825 р., термічним відновленням безводного хлориду алюмінію амальгамою калію.
Цей спосіб був удосконалений Фрідріхом Велером, який замість амальгами застосував чистий калій у 1827 р. Веллеру також належить перший приблизно точний опис властивостей металу.
У 1854 р. Анрі Сент-Клер Девіль удосконалив метод Веллера й налагодив промислове виробництво алюмінію. Девіль у процесі отримання алюмінію замінив калій дешевшим натрієм, а також хлорид алюмінію сумішшю AlCl3 з NaCl, за рахунок чого компоненти суміші перебували в розплавленому стані. Досліди на заводі Жавеля завершились успішно і 18 липня 1855 р. були отримані перші злитки металу масою 6–8 кг, які й були показані на Всесвітній виставці в Парижі [3]. У той час алюміній був настільки дорогим, що на виставці він був виставлений поряд зі скарбами з державної скарбниці, а імператор Наполеон III використовував посуд з алюмінію на державних прийомах.
У 1865 р. російський учений Микола Бекетов застосував реакцію взаємодії між кріолітом і магнієм для отримання алюмінію. Його спосіб мало чим відрізнявся від способу Девілля, але був простішим. У німецькому місті Гмелінгемі в 1885 р. був збудований завод, який працював за методом Бекетова, де за п’ять років було отримано 58 т алюмінію – більше 1/4 всього світового виробництва алюмінію протягом 1854–1890 рр.
Добування алюмінію хімічним способом не могло забезпечити промисловість дешевим металом, тому дослідникам довелось шукати інших способів виробництва алюмінію.
Ще в 1854 р. Бунзену вдалось отримати алюміній електролітичним шляхом, а саме електролізом подвійного хлориду натрію і алюмінію.
У 1886 р. Пауль Еру у Франції і Чарльз Холл у США майже одночасно, незалежно один від одного запропонували добувати алюміній електролізом глинозему, розплавленного в кріоліті, чим започаткували сучасний спосіб добування алюмінію. Світове виробництво алюмінію швидко зростало й у 1893 р. перевищило 1 тис. тон в рік. Подальші зміни цін на нього показано в таблиці.
Алюміній – сріблясто-білий легкий метал, добрий провідник тепла і електрики, пластичний, легко піддається механічній обробці.
Кристалічна структура і атомний радіус
Алюміній має кубічну гранецентровану кристалічну решітку (просторова група Fm3m). Найближча відстань між двома атомами становить 2,863Å. Прийнятий період кристалічної решітки алюмінію a = 4,0414 Å при кімнатній температурі. Кристалічна решітка стабільна при температурах від 4 К і до температури плавлення 933 К. Параметр решітки дуже слабо змінюється від наявності домішок.
Атомний радіус алюмінію визначений як половина між найближчими атомами-сусідами в кристалічній структурі й дорівнює 1,43Å. У кристалічній структурі алюмінію металічний зв’язок.
Густина
Теоретична густина алюмінію обрахована за параметрами його кристалічної решітки й становить 2,69872 г/см3. Експериментальні дані густини для полікристалічного алюмінію 99,996 % чистоти становлять 2,6989 (при 20 °C) г/см3, а для монокристалів – на 0,34 % вище.
Так, густина розплавленого алюмінію чистотою 99,996 % на 6,6 % менша, ніж у твердого металу, і при температурі 973 К становить 2 357 кг/м3 і майже лінійно знижується до 2 304 кг/м3 при температурі 1173 К.
Термічне розширення
Коефіцієнт термічного розширення α відпаленого алюмінію чистотою 99,99 % при температурі 293 К становить 23 · 10−6 і практично лінійно зростає до 37,3·10−6 К−1 при температурі 900 К.
Теплопровідність
Теплопровідність повністю відпаленого алюмінію у твердому стані знижується з ростом температури від 2,37 (298 К) до 2,08 Вт·см−1 · К−1 (933,5 К) і при температурах вище 100 К вона малочутлива до чистоти металу.
При нагріванні алюмінію і переході його з твердого стану в рідкий у нього різко зменшується теплопровідність: з 2,08 до 0,907 Вт · см−1 · К−1, а далі з ростом температури вона збільшується і при температурі 1 000 °C становить уже 1,01 Вт · см−1 · К−1.
Електропровідність
Питомий опір алюмінію високої чистоти (99,99 %) при температурі 20 °C становить 2,6548·10−8. Провідність алюмінію сильно залежить від його чистоти, причому вплив різних домішок залежить не тільки від концентрації цієї домішки, а й від того, чи вона перебуває у твердому розчині чи поза ним. Найбільш сильно підвищують опір алюмінію домішки хрому, літію, мангану, магнію, титану й ванадію. Питомий опір ρ (мкОм·м) відпаленого алюмінієвого дротика залежно від вмісту домішок (%) можна приблизно визначити за такою формулою:
ρ = 0,0264 + 0,007Si + 0,0007Fe + 0,04(Ti + V + Cr +Mn).
При температурі 1,175 ± 0,001 К алюміній переходить в надпровідний стан.
Питомий опір алюмінію при переході з твердого стану в рідкий стрибком зростає з 11 до 24 МкОм · см.
Плавлення і кристалізація
Температура плавлення алюмінію дуже чутлива до чистоти металу й для високочистого алюмінію (99,996 %) становить 933,4 К (660,3 °C), а температура початку кристалізації алюмінію за Міжнародною шкалою температур (1968 р.) вважається рівною 660,37 °C і використовується протягом десятків років для калібрування термопар. Підвищення зовнішнього тиску збільшує температуру плавлення алюмінію, і вона досягає 700 °C при тиску близько 100 МПа.
Температура кипіння алюмінію становить приблизно 2 452 °C, прихована теплота плавлення чистого алюмінію – 397 Дж · г−1, а прихована теплота випаровування – 9 462 Дж·г−1.
Питома теплоємність Ср алюмінію при 0 °C становить 0,90 Дж·г−1 · К−1, зі збільшенням температури вона зростає і визначається рівнянням:
Ср = С 0 + bT,
де С 0 – теплоємість при температурі 0 °C; b = 2,96 · 10−3;
T – температура, К.
Поверхневий натяг
Поверхневий натяг σ має максимальне значення при температурі плавлення й із ростом температури він знижується:
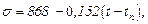
де σ – поверхневий натяг, Н/м;
t – температура, °C;
tп – температура плавлення алюмінію, °C.
В’язкість
В’язкість алюмінію при температурі плавлення становить 0,012 Па · с і збільшується за наявності навіть невеликого вмісту твердих включень, наприклад оксиду алюмінію і нерозчинних домішок. З ростом температури в’язкість знижується. Легуючі добавки Ti, Fe, Cu збільшують, а Si і Mg знижують в’язкість сплаву.
Термодинамічні властивості
Основні термодинамічні властивості алюмінію в рідкому й твердому станах наведені в табл. 11.5 (температура в Кельвінах, теплоємність, ентропія і ентальпія в Дж · моль−1 · К−1).
Таблиця 11.5
Не нашли, что искали? Воспользуйтесь поиском: