
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Классификация органических реакций по механизму. Примеры.
Механизм реакции предполагает детальное постадийное описание химических реакций. При этом устанавливают, какие именно ковалентные связи разрываются, в каком порядке и каким путем. Столь же тщательно описывают образование новых связей в процессе реакции.
Рассматривая механизм реакции, прежде всего обращают внимание на способ разрыва ковалентной связи в реагирующей молекуле. Таких способов два – гомолитический и гетеролитический.

Радикальные реакции протекают путем гомолитического (радикального) разрыва ковалентной связи:

Радикальному разрыву подвергаются неполярные или малополярные ковалентные связи
(С–С, N–N, С–Н) при высокой температуре или под действием света. Углерод в радикале СН3• имеет 7 внешних электронов (вместо устойчивой октетной оболочки в СН4). Радикалы неустойчивы, они стремятся захватить недостающий электрон (до пары или до октета). Один из способов образования устойчивых продуктов – димеризация (соединение двух радикалов):
СН3 • + • СН3 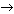 СН3: СН3,
СН3: СН3,
Н • + • Н 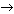 Н: Н.
Н: Н.
Радикальные реакции – это, например, реакции хлорирования, бромирования и нитрования алканов:

Ионные реакции протекают с гетеролитическим разрывом связи. При этом промежуточно образуются короткоживущие органические ионы – карбкатионы и карбанионы – с зарядом на атоме углерода. В ионных реакциях связывающая электронная пара не разъединяется, а целиком переходит к одному из атомов, превращая его в анион:

К гетеролитическому разрыву склонны сильно полярные (Н–O, С–О) и легко поляризуемые (С–Вr, С–I) связи.
Различают нуклеофильные реакции (нуклеофил – ищущий ядро, место с недостатком электронов) и электрофильные реакции (электрофил – ищущий электроны). Утверждение, что та или иная реакция является нуклеофильной или электрофильной, условно всегда относится к реагенту.
Реагент – участвующее в реакции вещество с более простой структурой.
Субстрат – исходное вещество с более сложной структурой.
Уходящая группа – это замещаемый ион, который был связан с углеродом.
Продукт реакции – новое углеродсодержащее вещество (записывается в правой части уравнения реакции).
К нуклеофильным реагентам (нуклеофилам) относят отрицательно заряженные ионы, соединения с неподеленными парами электронов, соединения с двойными углерод-углеродными связями.
К электрофильным реагентам (электрофилам) относят положительно заряженные ионы, соединения с незаполненными электронными оболочками (АlCl3, ВF3, FeCl3), cоединения с карбонильными группами, галогены. Электрофилы – любые атом, молекула или ион, способные присоединить пару электронов в процессе образования новой связи.
Движущая сила ионных реакций – взаимодействие противоположно заряженных ионов или фрагментов разных молекул с частичным зарядом ( + и
+ и  –).
–).
Примеры ионных реакций разных типов.
Нуклеофильное замещение:

Электрофильное замещение:

Нуклеофильное присоединение (сначала присоединяется CN–, потом Н+):

Электрофильное присоединение (сначала присоединяется Н+, потом Х–):

Элиминирование при действии нуклеофилов (оснований):

Элиминирование при действииэлектрофилов (кислот):

Не нашли, что искали? Воспользуйтесь поиском: