
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электрохимический потенциал и равнове-сие на границе электрод/раствор
Основы термодинамики гетерогенных электрохимических систем
При рассмотрении равновесий на границе фаз с участием заряженных частиц (в частности, на границе электрод/раствор) фундаментальное значение имеет понятие электрохимического потенциала. Формально электрохимический по-тенциал можно определить по аналогии с определением химического потенциала. Как следует из химической термодинамики химиче-ский потенциал незаряженной частицы (компо-нента)
 , (6.1.1)
, (6.1.1)
где 𝘎 – свободная энергия Гиббса (термоди-намический изобарный потенциал); ρ – давление; Т – температура;  - число молей всех других компонентов системы, за исключением компоне-нта i.
- число молей всех других компонентов системы, за исключением компоне-нта i.
Величина 𝘎 зависит от состава системы, давления и температуры. Если компонент i представлен заряженными частицами, то его состояние в системе кроме состава, давления и температуры зависит также от напряженности электрического поля. Поэтому для полного описания поведения заряженных частиц в системе вводят электрохимическую свободную энергию Гиббса  , полный дифференциал кото-рой равен
, полный дифференциал кото-рой равен
d  = –SdT +Vdp
= –SdT +Vdp  , (6.1.2)
, (6.1.2)
где S – энтропия; V – объем системы;  – электрический потенциал в той части сис-темы, где находятся i;
– электрический потенциал в той части сис-темы, где находятся i;  zi – зарядовое число частиц компонента i c учетом знака; F – число Фарадея.
zi – зарядовое число частиц компонента i c учетом знака; F – число Фарадея.
По аналогии с соотношением (6.1.1) элек-трохимический потенциал заряженных частиц i определяется производной от величины  по чи-cлу молей данного компонента:
по чи-cлу молей данного компонента:
 . (6.1.3)
. (6.1.3)
Из уравнений (6.1.2) и (6.1.3) следует:
 (6.1.4)
(6.1.4)
При рассмотрении явлений на границах раздела фаз необходимо указывать, к какой фазе относятся величины  ,
,  и
и 
Фазу обозначают верхние индексы; нап-ример, для фазы 
 =
=  F
F  (6.1.5)
(6.1.5)

Физический смысл величин, входящих в  внима-ния. Предположим, что проводящая фаза
внима-ния. Предположим, что проводящая фаза  (металл или раствор электролита) имеет форму сферы и весь ее электрический заряд сосре-доточен в тонком поверхностном слое, а заряже-нная частица
(металл или раствор электролита) имеет форму сферы и весь ее электрический заряд сосре-доточен в тонком поверхностном слое, а заряже-нная частица  находится в вакууме на бесконе-чно большом расстоянии от фазы
находится в вакууме на бесконе-чно большом расстоянии от фазы  (рис. 6.1, а). Если перенести эту частицу внутрь фазы
(рис. 6.1, а). Если перенести эту частицу внутрь фазы  , то затраченная работа после умножения на число Авогадро как и даст величину
, то затраченная работа после умножения на число Авогадро как и даст величину  .
.
Чтобы разделить эту работу на «химиче-скую» и «электростатическую» составляющие, предположим, что с фазы  можно мысленно снять заряженный поверхностный слой, падение потенциала в котором характеризуется величи-ной поверхностного потенциала
можно мысленно снять заряженный поверхностный слой, падение потенциала в котором характеризуется величи-ной поверхностного потенциала  . Для раст-воров величина
. Для раст-воров величина  обусловлена определенной ориентацией находящихся на поверхности дипо-лей растворителя, а на границе металл/вакуум поверхностный потенциал возникает из-за того, что электронный газ частично смещается относи-тельно ионов кристаллической решётки металла и вместе с их положительными зарядами также образует дипольный слой. Чтобы в такую пустую заряженную оболочку внести из бесконечности частицу I с зарядом
обусловлена определенной ориентацией находящихся на поверхности дипо-лей растворителя, а на границе металл/вакуум поверхностный потенциал возникает из-за того, что электронный газ частично смещается относи-тельно ионов кристаллической решётки металла и вместе с их положительными зарядами также образует дипольный слой. Чтобы в такую пустую заряженную оболочку внести из бесконечности частицу I с зарядом  , нужно затратить работу
, нужно затратить работу  (рис. 6.1, б). Умножив эту работу на чис-ло Авогадро, получим электростатическую со-ставляющую электрохимического потенциала
(рис. 6.1, б). Умножив эту работу на чис-ло Авогадро, получим электростатическую со-ставляющую электрохимического потенциала  . Входящая сюда величина
. Входящая сюда величина  называется внутренним потенциалом фазы
называется внутренним потенциалом фазы 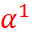 .
.
______________________________
1) Например, если фаза  является металличе-ским шариком с радиусом r и с общим зарядом
является металличе-ским шариком с радиусом r и с общим зарядом  , то внешний потенциал, согласно формуле (2.3.3),равен
, то внешний потенциал, согласно формуле (2.3.3),равен 
Внутренний потенциал аддитивно складыва-ется из внешнего потенциала  , обусловлен-ного свободными электростатическими зарядами фазы
, обусловлен-ного свободными электростатическими зарядами фазы 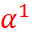 , и поверхностного потенциала
, и поверхностного потенциала  :
:
 (6.1.6)
(6.1.6)
Если свободный электростатический заряд фазы  равен нулю, то
равен нулю, то  = 0, и тогда
= 0, и тогда  =
= 
Приведенное определение  соответствует обычно принятому определению потенциала как работы перенесения единичного воображаемого заряда из бесконечности в вакууме в данную точку. Термин «воображаемый» предполагает, что этот единичный заряд реагирует только на внешнее электрическое поле и не взаимо-действует со средой.
соответствует обычно принятому определению потенциала как работы перенесения единичного воображаемого заряда из бесконечности в вакууме в данную точку. Термин «воображаемый» предполагает, что этот единичный заряд реагирует только на внешнее электрическое поле и не взаимо-действует со средой.
Рассмотрим работу внесения заряженной частицы i из вакуума внутрь оставшейся не-заряженной сферы, лишенной также простра-нственно разделенных зарядов на поверхно-сти (рис. 6.1, в). При умножении на число Авогадро эта работа даёт  , т.е. химический потенциал i в фазе
, т.е. химический потенциал i в фазе  . Если, например, фаза
. Если, например, фаза  представляет собой бесконечно разбавленный раствор, а частица i является ионом, то величина
представляет собой бесконечно разбавленный раствор, а частица i является ионом, то величина  обусловлена энергией ион-дипо-льного взаимодействия и равна химической эне-ргии сольватации. Химическая энергия взаимо-действия заряженной частицы с фазой также обусловлена электрическими по своей природе силами, но только более сложными, нежели кулоновское взаимодействие заряда с заданным полем.
обусловлена энергией ион-дипо-льного взаимодействия и равна химической эне-ргии сольватации. Химическая энергия взаимо-действия заряженной частицы с фазой также обусловлена электрическими по своей природе силами, но только более сложными, нежели кулоновское взаимодействие заряда с заданным полем.
Экспериментальному определению доступна работа переноса только реальной частицы (элек-трона, иона и т.п.). Поэтому в любых опытах измеряется или электрохимический потенциал, или разность электрохимических потенциалов, относящихся к фазам 
 ) + (
) + ( (6.1.7)
(6.1.7)
Из соотношения (6.1.7) следует принципиально важный вывод о том, что электрическую раз-ность потенциалов можно лишь измерить между точками, которые находятся в одинаковых по химическому составу фазах. В самом деле, в этих условиях 

Таким образом измеряется, например, разность потенциалов между двумя разными кусками одного и того же металла или между различными точками в вакууме. Если же точки расположены в различных по химическому составу фазах, то электрическую разность потенциалов между ними измерить невозможно. Например, нельзя измерить разность внутренних потенциалов на границе двух фаз
 , (6.1.8)
, (6.1.8)
т.е. так называемый гальвани-потенциал.
Предположим, что на границе элект-род/раствор в результате протекания процессов с участием заряженных и незаряженных частиц устанавливается равновесие:
 (6.1.A)
(6.1.A)
где А, В, L, M – различные компоненты реакции (в том числе и электроны);
 соответствующие стехиометриче-ские коэффициенты.
соответствующие стехиометриче-ские коэффициенты.
Изменение электрохимической свободной энергии Гиббса для рассматриваемой системы можно записать в виде
d  (6.1.9)
(6.1.9)
где 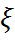 =
=  – химическая переменная, т.е. масса реагирующего вещества, выраженная в грамм-эквивалентах.
– химическая переменная, т.е. масса реагирующего вещества, выраженная в грамм-эквивалентах.
По аналогии с условием химического равно-весия 
получаем условие равновесия на границе элект-род/раствор:
 (6.1.10)
(6.1.10)
Вместо соотношения для условия электрохи-мического равновесия удобно записать эквивале-нтное выражение
 (6.1.11)
(6.1.11)
где индекс i относится к исходным компонентам электрохимической реакции, а индекс f – к конечным.
У электрохимических потенциалов заряжен-ных частиц верхний индекс должен указывать фазу, к которой относится этот компонент. Для незаряженных частиц, как следует из уравнения (6.1.4), электрохимический потенциал равен химическому и указание фазы необязательно.
Рассмотрим два простейших примера устано-вления электрохимического равновесия на гра-нице раздела фаз.
А. Граница двух различных металлов. При установлении равновесия на этой границе происходит выравнивание электрохимических потенциалов электронов в металлах 
 (6.1.11)
(6.1.11)
Условие равновесия имеет вид
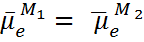 или
или  откуда для гальвани-потенциала на границе металл/металл получаем выражение
откуда для гальвани-потенциала на границе металл/металл получаем выражение

 (6.1.12)
(6.1.12)
Таким образом, в условиях равновесия рабо-та переноса электрона из одного металла в другой равна нулю, но работа переноса единицы воображаемого заряда, т.е.  отлична от ну-ля, поскольку химические потенциалы электрона в различных металлах неодинаковы.
отлична от ну-ля, поскольку химические потенциалы электрона в различных металлах неодинаковы.
Не нашли, что искали? Воспользуйтесь поиском: