
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Окислительно-восстановительные полуре-акции и понятие электродного потенциала
Химическую реакцию, сопровождающуюся переходом электронов между молекулами двух участвующих в реакции веществ, можно запи-сать в общей форме:
 (6.3.A)
(6.3.A)
где Ox  Red
Red  востанов-ленная форма.
востанов-ленная форма.
Если реакцию (6.3.А) удаётся осуществить в электрохимической системе, то она разбивается на два электродных процесса, или на две окис-лительно-восстановительные полуреакции:
 , (6.3.Б)
, (6.3.Б)
O  . (6.3.В)
. (6.3.В)
При этом стехиометрические коэффициенты  в реакциях (6.3.A) соответствуют усло-вию
в реакциях (6.3.A) соответствуют усло-вию
 (6.3.1)
(6.3.1)
где n  число электронов, которое должно пройти через электрохимическую цепь, чтобы в ней осуществилось однократное протекание суммарной реакции (6.3.A).
число электронов, которое должно пройти через электрохимическую цепь, чтобы в ней осуществилось однократное протекание суммарной реакции (6.3.A).
Практически n определяется как наименьшее общее кратное чисел 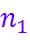 и
и  . Умножая урав-нение процесса (6.3.Б) на
. Умножая урав-нение процесса (6.3.Б) на  , а уравнение про-цесса (6.3.В)
, а уравнение про-цесса (6.3.В)  на
на  и вычитая одно из другого, получим реакцию (6.3.A).
и вычитая одно из другого, получим реакцию (6.3.A).
Комбинируя относительно небольшое число электродных процессов, можно получить множе-ство самых различных химических реакций1.
___________________
1 Комбинация N электродных процессов даёт  химических реакций.
химических реакций.
Поэтому целесообразно иметь энергетиче-ские характеристики этих процессов, чтобы пу-тём их комбинации находить термодинамиче-ские характеристики различных химических реа-кций. Так возникает проблема электродных поте-нциалов, т.е. таких величин, которые характе-ризовали бы процессы (6.3.Б) и (6.3.В) в такой же степени, как ЭДС электрохимической цепи хара-ктеризует суммарную реакцию (6.3.A). При этом предполагается, что разность этих электродных потенциалов равна ЭДС суммарной химической реакции.
В. Нернст предполагал, что на границе двух различных металлов не возникает разности поте-нциалов (т.е.  а потому ЭДС цепи складывается из двух скачков потенциала на гра-ницах
а потому ЭДС цепи складывается из двух скачков потенциала на гра-ницах

Исходя из этих представлений, В. Оствальд предложил рассматривать скачки потенциала на границе металл/раствор (т. е. фактически гальва-ни-потенциалы  ) в качестве абсолютных электродных потенциалов. Ошибочность такого решения проблемы электродного потенциала со-стояла в том, что на самом деле электрохи-мическая цепь, построенная из двух различных металлов, содержит три, а не два гальвани-поте-нциала, поскольку
) в качестве абсолютных электродных потенциалов. Ошибочность такого решения проблемы электродного потенциала со-стояла в том, что на самом деле электрохи-мическая цепь, построенная из двух различных металлов, содержит три, а не два гальвани-поте-нциала, поскольку  Следовательно, ЭДС таких цепей нельзя получить из разности двух гальвани-потенциалов
Следовательно, ЭДС таких цепей нельзя получить из разности двух гальвани-потенциалов  . Даже для огра-ниченного числа цепей типа
. Даже для огра-ниченного числа цепей типа
Pt| Fe (III)/ Fe(II)  Ce(IV)/Ce(III) | Pt,
Ce(IV)/Ce(III) | Pt,
в которых электроды имеют одинаковый химиче-ский состав, теория абсолютных электродных потенциалов оказалась практически неприем-лемой из-за невозможности экспериментального измерения отдельного гальвани-потенциала.
В настоящее время электродным потен-циалом называют ЭДС электрохимической цепи, построенной из стандартного водородного элек-трода и электрода окислительно-восстановите-льной полуреакции. Цепь с водородным элект-родом достаточно просто реализовать для вод-ных растворов, тогда как для неводных систем приходится преодолевать проблемы скачков по-тенциала на границе жидкость/жидкость. В стан-дартном водородном электроде (с.в.э.) платини-рованная платина в растворе кислоты с единич-ной активностью (фактически используют раст-воры с  омывается током водорода, дав-ление которого равно 1,01
омывается током водорода, дав-ление которого равно 1,01  Па (1 атм). Пред-полагается, что диффузионный потенциал на гра-нице двух растворов элиминирован, а на границе второго электрода с раствором протекает исс-ледуемая окислительно-восстановительная полу-реакция. При записи электродного потенциала стандартный водородный электрод всегда распо-лагается слева:
Па (1 атм). Пред-полагается, что диффузионный потенциал на гра-нице двух растворов элиминирован, а на границе второго электрода с раствором протекает исс-ледуемая окислительно-восстановительная полу-реакция. При записи электродного потенциала стандартный водородный электрод всегда распо-лагается слева:
Pt, 
Pt, 
Предположим, что на границах раздела раствор (I)/  и раствор (II)/
и раствор (II)/  в этих цепях осуществляются электродные процессы соотве-тственно (6.3.Б) и (6.3.В). Электродные потен-циалы
в этих цепях осуществляются электродные процессы соотве-тственно (6.3.Б) и (6.3.В). Электродные потен-циалы  и
и 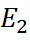 соответствуют, однако не этим процессам, а полным химическим реакциям
соответствуют, однако не этим процессам, а полным химическим реакциям

 (6.3.Г)
(6.3.Г)

 (6.3.Д)
(6.3.Д)
Но если умножить уравнение (6.3.Г) на  , а уравнение (6.3.Д)
, а уравнение (6.3.Д)  на
на  и вычесть вторую строку из первой, то с учётом соотношения (6.3.1) получим химическую реакцию (6.3.А). Иначе говоря, комбинация различных реакций типа (6.3.Г) и (6.3.Д), как и комбинация различных электродных процессов типа (6.3.Б) и (6.3.В), позволяет получить самые разнообраз-ные химические реакции. Поэтому при записи реакций, соответствующих электродным потен-циалам, обычно для сокращения пишут элект-родные процессы типа (6.3.Б) и (6.3.В) или даже ещё более кратко: Ox/Red. Например, вместо реакции
и вычесть вторую строку из первой, то с учётом соотношения (6.3.1) получим химическую реакцию (6.3.А). Иначе говоря, комбинация различных реакций типа (6.3.Г) и (6.3.Д), как и комбинация различных электродных процессов типа (6.3.Б) и (6.3.В), позволяет получить самые разнообраз-ные химические реакции. Поэтому при записи реакций, соответствующих электродным потен-циалам, обычно для сокращения пишут элект-родные процессы типа (6.3.Б) и (6.3.В) или даже ещё более кратко: Ox/Red. Например, вместо реакции
 ,
,
отвечающей ЭДС цепи
Pt, 
т. е. электродному потенциалу меди, обычно пи-шут
C 
или просто C 
Рассмотрим разность электродных потен-циалов  Знак электродного потенциала определяется направлением реакций (6.3.Г) и (6.3.Д) при их самопроизвольном протекании. Так, если происходит самопроизвольное восстановление вещества Ox газообразным водородом, то
Знак электродного потенциала определяется направлением реакций (6.3.Г) и (6.3.Д) при их самопроизвольном протекании. Так, если происходит самопроизвольное восстановление вещества Ox газообразным водородом, то  если же, наоборот, самопроизвольно идёт обратная реакция Red +
если же, наоборот, самопроизвольно идёт обратная реакция Red +  с выделением
с выделением  E
E  Таким образом, при
Таким образом, при  на левом электроде образуются электроны, а на правом они потребляются. Во внешней цепи при
на левом электроде образуются электроны, а на правом они потребляются. Во внешней цепи при  электроны будут перемещаться слева направо, а внутри цепи слева направо должно происходить перемещение катионов, тогда как перемещение анионов, наоборот, справа налево. Каждая величина электродного потенциала складывается из трёх гальвани-потенциалов. Например,
электроны будут перемещаться слева направо, а внутри цепи слева направо должно происходить перемещение катионов, тогда как перемещение анионов, наоборот, справа налево. Каждая величина электродного потенциала складывается из трёх гальвани-потенциалов. Например,
 (6.3.2)
(6.3.2)
и  (6.3.3)
(6.3.3)
Согласно уравнению (6.1.12)

 (6.1.12)
(6.1.12)
 =
=  и
и  =
= 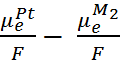 .
.
Вычитание (6.3.3) из (6.3.2) даёт:
 =
=  (6.3.4)
(6.3.4)
Таким образом, разность электродных потен-циалов равна ЭДС цепи
 , в которой совершается суммарная химическая реакция (6.3.А).
, в которой совершается суммарная химическая реакция (6.3.А).
Если оказывается, что E = ( то реакция (6.3.А) самопроизвольно протекает слева направо, а если E
то реакция (6.3.А) самопроизвольно протекает слева направо, а если E  . Количественно величина E =
. Количественно величина E =  харак-теризует изменение свободной энергии Гиббса для реакции (6.3.А).
харак-теризует изменение свободной энергии Гиббса для реакции (6.3.А).
Система относительных электродных потен-циалов, построенная с использованием произво-льно выбранного электрода сравнения (практи-чески с.в.э.  стандартный водородный элект-род), позволяет решить проблему электродного потенциала. Относительный характер принятых электродных потенциалов можно показать, если прибавить к значениям всех электродных потенциалов какое-либо постоянное число А, так что вместо
стандартный водородный элект-род), позволяет решить проблему электродного потенциала. Относительный характер принятых электродных потенциалов можно показать, если прибавить к значениям всех электродных потенциалов какое-либо постоянное число А, так что вместо  получим
получим  вместо
вместо  получим
получим  и т. д. Вся шкала при этом сместится, но разность (
и т. д. Вся шкала при этом сместится, но разность ( )
)  по-прежнему даёт ЭДС суммарной химической реакции.
по-прежнему даёт ЭДС суммарной химической реакции.
Величины электродных потенциалов зависят от концентрации всех компонентов, участву-ющих в окислительно-восстановительной полу-реакции. Зависимость эта выражается уравнени-ем Нернста (6.2.8). Стандартная ЭДС цепи
Pt,  | HA
| HA  MA | M | Pt
MA | M | Pt
называется стандартным электродным потен-циалом. Если некоторые компоненты в окисли-тельно-восстановительной полуреакций являю-тся твердыми веществами, то их химический потенциал не изменяется в ходе реакции и учитывается стандартным электродным потен-циалом.
Значения стандартных электродных потенциалов ряда окислительно-восстановительных полуре-акций при 25  и давлении 1 атм представлены в табл. 6.11. При помощи таблицы стандартных потенциалов можно легко составлять уравне-_____________________________
и давлении 1 атм представлены в табл. 6.11. При помощи таблицы стандартных потенциалов можно легко составлять уравне-_____________________________
1 В современных справочниках имеются значительно более полные таблицы стандартных потенциалов (более чем для 500 электродных процессов). Соответственно, можно рассчитать ЭДС для более чем 12 тысяч электрохимических реакций.
ния самых различных химических реакций, решать вопрос о направлении этих реакций и полноте их протекания. Рассмотрим, например, используемую в аналитической химии реакцию определения иона  при помощи висмутата натрия. Катион
при помощи висмутата натрия. Катион  при реакции Bi
при реакции Bi  окисляется до аниона перманганата Mn
окисляется до аниона перманганата Mn 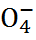 , кото-рый легко обнаруживается по фиолетовой окрас-ке раствора. Из таблицы стандартных потен-циалов имеем:
, кото-рый легко обнаруживается по фиолетовой окрас-ке раствора. Из таблицы стандартных потен-циалов имеем:
Bi 
Mn 
 = 1,507 B.
= 1,507 B.
Для  2 и
2 и  =5 наименьшее общее крат-ное n = 10, а потому
=5 наименьшее общее крат-ное n = 10, а потому  и
и  Суммарная химическая реакция типа (6.3.A) в данном примере записывается в виде
Суммарная химическая реакция типа (6.3.A) в данном примере записывается в виде
5Bi  Поскольку
Поскольку  то при активностях всех компонентов, равных единице должна идти слева направо. Равновесие должно наступить, когда выравняются потенциалы
то при активностях всех компонентов, равных единице должна идти слева направо. Равновесие должно наступить, когда выравняются потенциалы  , т. е. при
, т. е. при
1, 759 + 
откуда
lg  Этот результат можно получить сразу, если воспользоваться формулой
Этот результат можно получить сразу, если воспользоваться формулой 
 =
=  ln
ln  . (6.2.12)
. (6.2.12)
Таким образом, для рассматриваемой реак-ции 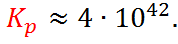 Столь большое значение кон-станты равновесия указывает на практически полное смещение этой реакции вправо. Большая подборка систематических расчётов равновесных потенциалов содержится в так называемом атласе Пурбе1
Столь большое значение кон-станты равновесия указывает на практически полное смещение этой реакции вправо. Большая подборка систематических расчётов равновесных потенциалов содержится в так называемом атласе Пурбе1  сборнике диаграмм E
сборнике диаграмм E  pH для водных систем. При построении диаграмм Пурбе для каждого из элементов рассмотрение ограничено равновесиями с уча-стием растворенных, твердых и газообразных веществ, в состав которых входят данный элемент, водород и кислород. На рис. 6.4 дан пример такой диаграммы для марганца.
pH для водных систем. При построении диаграмм Пурбе для каждого из элементов рассмотрение ограничено равновесиями с уча-стием растворенных, твердых и газообразных веществ, в состав которых входят данный элемент, водород и кислород. На рис. 6.4 дан пример такой диаграммы для марганца.
E, B –2 0 2 4 6 8 10 12 14 16




 2,0 2,0
2,0 2,0




 1,6 Mn
1,6 Mn  1,6
1,6



 б
б
 1,2 Mn
1,2 Mn  –6 –4 –2 0 1,2
–6 –4 –2 0 1,2










 0,8
0,8
Mn 



 0,4 0,4
0,4 0,4
 M
M 



 0 а
0 а  0
0





 –0,4 M
–0,4 M  –0,4
–0,4
–0,8 Mn(OH  –0,8
–0,8
HMn 



 –1,2 –1,2
–1,2 –1,2
 | |||
 |

 –1,6 –1,6
–1,6 –1,6
–2 0 2 4 6 8 10 12 14 16
Рис. 6.4. Диаграмма Е – рН для системы
марганец – вода при 25 
По диаграммам Пурбе можно легко установить, какие компоненты являются неус-тойчивыми в водных растворах, разлагая воду с выделением водорода и кислорода. Пунктирные параллельные прямые линии а и б с наклоном 0.06 В/рН, отстоящие друг от друга на 1,23 В, на рис. 6.4 ограничивают область термодинами-ческой устойчивости воды, они отвечают равно-весиями Н2О/О2 и Н2/Н2О.
_______________________
1Атлас назван по имени его создателя  бельгий-ского ученого М. Пурбе.
бельгий-ского ученого М. Пурбе.
Каждая из сплошных линий на диаграммах Пурбе отвечает границе области термодинами-ческой устойчивости компонентов системы. Если в равновесии участвует наряду с  и О
и О  ещё какой либо ион в растворе, то его конце-нтрация влияет, в соответствии с уравнением Нернста, на положение границы области устой-чивости. В атласе Пурбе в этом случае приво-дятся серии границ для концентраций 1
ещё какой либо ион в растворе, то его конце-нтрация влияет, в соответствии с уравнением Нернста, на положение границы области устой-чивости. В атласе Пурбе в этом случае приво-дятся серии границ для концентраций 1  1М (в логарифмической шкале – показа-тели степени −6, −4, −2 и 0 соответственно). Для других концентраций граничные значения потен-циалов можно пересчитать по приведенным в атласе уравнениям. Если в равновесии находятся две твердые фазы (например,
1М (в логарифмической шкале – показа-тели степени −6, −4, −2 и 0 соответственно). Для других концентраций граничные значения потен-циалов можно пересчитать по приведенным в атласе уравнениям. Если в равновесии находятся две твердые фазы (например, 
 ), а ионы, за исключением
), а ионы, за исключением  и О
и О  то их устойчивости в нем не участвуют, то их устойчивости разделяет единственная линия. Наряду с величинами стандартных потенциалов при расчетах диаграмм Пурбе часто использу-ются ещё две группы термодинамических данных – стандартные свободные энергии обра-зования твердых соединений (или произведения растворимости) и константы, характеризующие кислотно-основные равновесия. Некоторые из этих величин косвенным образом входят в таблицы стандартных потенциалов. Например, различия стандартных потенциалов для сис-тем
то их устойчивости в нем не участвуют, то их устойчивости разделяет единственная линия. Наряду с величинами стандартных потенциалов при расчетах диаграмм Пурбе часто использу-ются ещё две группы термодинамических данных – стандартные свободные энергии обра-зования твердых соединений (или произведения растворимости) и константы, характеризующие кислотно-основные равновесия. Некоторые из этих величин косвенным образом входят в таблицы стандартных потенциалов. Например, различия стандартных потенциалов для сис-тем  и T
и T  (см. табл. 6.1) опреде-ляются низкой растворимостью высшего оксида и отражают вклад в баланс свободной энергии величин
(см. табл. 6.1) опреде-ляются низкой растворимостью высшего оксида и отражают вклад в баланс свободной энергии величин  энергии образования этого оксида. Для тяжелых элементов, ионы которых склонны к самопроизвольной дегидратации, именно оксиды являются термодинамически устойчивыми фор-мами нерастворимых кислородных соединений. Однако во многих случаях произведения раст-воримости оксидов и соответствующих им гидроксидов сравнимы, и вопрос о наиболее устойчивой форме не имеет однозначного решения. Обычно в атласе Пурбе приводятся две версии диаграммы для одной и той же системы: полученные путем подстановки в расчет термо-динамических данных для гидратированных и полностью дегидратированных соединений. Следует отметить, что твердые соединения всех элементов рассматриваются при составле-нии таблиц стандартных потенциалов и постро-ении диаграмм Пурбе как строго стехиоме-трические. Однако многие реальные твердые оксиды, гидроксиды и соли имеют широкие области гомогенности, и свободные энергии их образования зависят от состава. Соответственно, стандартные потенциалы систем ион металла/ оксид металла также различаются для стехиометрических и нестехиометрических соединений. Измерения равновесных потен-циалов могут быть, таким образом, исполь-зованы для решения обратной задачи − расчета термодинамических характеристик веществ пе-ременного состава. Это также имеет значение для твердых растворов и различных твердых и жидких сплавов, хотя соответствующие энергии их образования обычно гораздо ниже, чем эне-ргии образования химических соединений. Тем не менее для некоторых систем различия станда-ртных потенциалов, обусловленные сплавооб-разованием, очень впечатляющи, как, например, для систем
энергии образования этого оксида. Для тяжелых элементов, ионы которых склонны к самопроизвольной дегидратации, именно оксиды являются термодинамически устойчивыми фор-мами нерастворимых кислородных соединений. Однако во многих случаях произведения раст-воримости оксидов и соответствующих им гидроксидов сравнимы, и вопрос о наиболее устойчивой форме не имеет однозначного решения. Обычно в атласе Пурбе приводятся две версии диаграммы для одной и той же системы: полученные путем подстановки в расчет термо-динамических данных для гидратированных и полностью дегидратированных соединений. Следует отметить, что твердые соединения всех элементов рассматриваются при составле-нии таблиц стандартных потенциалов и постро-ении диаграмм Пурбе как строго стехиоме-трические. Однако многие реальные твердые оксиды, гидроксиды и соли имеют широкие области гомогенности, и свободные энергии их образования зависят от состава. Соответственно, стандартные потенциалы систем ион металла/ оксид металла также различаются для стехиометрических и нестехиометрических соединений. Измерения равновесных потен-циалов могут быть, таким образом, исполь-зованы для решения обратной задачи − расчета термодинамических характеристик веществ пе-ременного состава. Это также имеет значение для твердых растворов и различных твердых и жидких сплавов, хотя соответствующие энергии их образования обычно гораздо ниже, чем эне-ргии образования химических соединений. Тем не менее для некоторых систем различия станда-ртных потенциалов, обусловленные сплавооб-разованием, очень впечатляющи, как, например, для систем  и
и  ) (см.табл. 6.1). Ещё одна типичная зависимость равновес-ных потенциалов от свойств твёрдого вещества, участвующего в равновесии, проявляется при сравнении табличных значений для различных аллотропных модификаций. В табл. 6.1 приведён пример для равновесий с участием белого и красного фосфора, различающихся стандартной свободной энергией образования.
) (см.табл. 6.1). Ещё одна типичная зависимость равновес-ных потенциалов от свойств твёрдого вещества, участвующего в равновесии, проявляется при сравнении табличных значений для различных аллотропных модификаций. В табл. 6.1 приведён пример для равновесий с участием белого и красного фосфора, различающихся стандартной свободной энергией образования.
Необходимо отметить, что при стандартных условиях истинно равновесной является всегда только одна из твердых фаз (аллотропных моди-фикаций), тогда как остальные метастабильны. Однако если речь идет, как в приведенных примерах, о долгоживущих метастабильных состояниях (т. е. если время установления окис-лительно-восстановительного равновесия гораз-до меньше, чем время превращения в стаби-льную модификацию), термодинамическое расс-мотрение остается вполне корректным. Пользуясь диаграммами Пурбэ, следует пом-нить, что они получены в предположении об установлении в соответствующих системах пол-ного термодинамического равновесия. Для реа-льных систем это условие выполняется далеко не всегда из-за низких скоростей большого числа процессов. В настоящее время некоторые базы данных снабжены стандартным программным обеспечением, которое позволяет строить диаг-раммы Пурбэ с учетом существования всех включенных в данную базу термодинамически охарактеризованных фаз, включая нестехиоме-трические.
E, B –2 0 2 4 6 8 10 12 14 16




 2,0 2,0
2,0 2,0





 1,6 Mn
1,6 Mn  1,6
1,6



 б
б
 1,2 Mn
1,2 Mn  –6 –4 –2 0 1,2
–6 –4 –2 0 1,2










 0,8
0,8
Mn 



 0,4 0,4
0,4 0,4
 M
M 




 0 а
0 а  0
0





 –0,4 M
–0,4 M  –0,4
–0,4
–0,8 Mn(OH  –0,8
–0,8
HMn 



 –1,2 –1,2
–1,2 –1,2
 | |||
 |

 –1,6 –1,6
–1,6 –1,6
–2 0 2 4 6 8 10 12 14 16
Рис. 6.4. Диаграмма Е – рН для системы
марганец – вода при 25 
Не нашли, что искали? Воспользуйтесь поиском: