
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Порядок выполнения работы. 1. Определяют точную концентрацию раствора гидроксида натрия
1. Определяют точную концентрацию раствора гидроксида натрия. Для этого отбирают в три колбы аликвоты раствора гидроксида натрия по 10 мл, доводят дистиллированной водой до объема приблизительно 100 мл и титруют 0,1 Н раствором соляной кислоты в присутствии фенолфталеина до перехода окраски из малиновой в бесцветную. Рассчитывают концентрацию гидроксида натрия по среднему объему соляной кислоты, использованной на титрование.
2. Определяют точную концентрацию исходного раствора уксусной кислоты. Для этого отбирают 100 мл уксусной кислоты (~1 Н) и титруют гидроксидом натрия в присутствии фенолфталеина. Рассчитывают концентрацию уксусной кислоты с учетом концентрации гидроксида натрия, определенной в пункте 1.
3. Разбавлением 1Н раствора уксусной кислоты приготавливают в шести колбах, к которым имеются пробки, растворы как указано в табл. 5.1. Для этого в мерную колбу на 100 мл вводят пипеткой указанное количество 1 Н уксусной кислоты и доводят объем до метки дистиллированной водой. Затем приготовленный раствор переносят в колбу емкостью 250 мл с пробкой. Так готовят шесть растворов. Приготовление начинают с наименее концентрированного раствора.
Таблица 5.1
Приготовление растворов уксусной кислоты
| Номер колбы | ||||||
| Объем 1 Н раствора, мл | 1,2 | 2,5 | ||||
| Нормальность, моль/л | 0,012 | 0,025 | 0,05 | 0,1 | 0,2 | 0,4 |
4. В каждую колбу помещают 3 г активированного угля (6 таблеток). Колбы закрывают пробками и взбалтывают в течение 10 минут. Затем растворы фильтруют в чистые сухие колбы. В фильтрате точное содержание уксусной кислоты определяют титрованием 0,1 Н раствором гидроксида натрия, используя в качестве индикатора фенолфталеин.
5. Результаты эксперимента заносят в табл. 5.2.
Таблица 5.2
Результаты эксперимента
| Номер колбы | ||||||
| Нормальность исходного раствора N0, моль/л | ||||||
| Нормальность раствора после адсорбции Nк, моль/л | ||||||
| Величина сорбции А,ммоль/г | ||||||
| ln А | ||||||
| ln Nк |
N0 определяется с учетом исходной концентрации уксусной кислоты до разбавления, определенной в пункте 2.
Nк определяется в пункте 4.
Величина сорбции рассчитывается по формуле
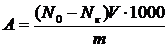 , (6.1)
, (6.1)
где V – объем раствора, мл;
m – масса сорбента, г.
6. Построить изотерму сорбции в координатах А – Nк. Определить вид полученной изотермы.
Построить линейную зависимость ln А – ln Nк. Обработав данную зависимость методом наименьших квадратов определить значения постоянных параметра K и n в уравнении Фрейндлиха.
Сделать выводы по работе.
Вопросы для контроля
1. Адсорбция, адсорбент, адсорбат, десорбция.
2. Механизмы адсорбции.
3. Адсорбция на твердой поверхности: изотермы Генри, Ленгмюра, Фрейндлиха, полимолекулярная адсорбция.
Не нашли, что искали? Воспользуйтесь поиском: