
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химический потенциал
Существуют многокомпонентные системы, состоящие из большого числа фаз, причём их состав меняется в зависимости от температуры, давления и т.д. Если в системе имеется несколько компонент, то её внутренняя энергия зависит от концентрации n i каждой из компонент. В качестве других независимых переменных, от которых зависит внутренняя энергия, удобно взять объём V и энтропию S, т.е. записать
 . (1.143)
. (1.143)
Тогда
 , (1.144)
, (1.144)
где суммирование производится по всем ni, а при взятии частной производной по ni остальные ni ≠ nj считаются постоянными. Учитывая, что (см. 1.119)

получим
 , (1.145)
, (1.145)
где  . (1.146)
. (1.146)
Аналогично, с учётом переменного числа частиц можно модифицировать и остальные термодинамические функции. Например, термодинамический потенциал Гиббса G будет выглядеть так:
 , (1.147)
, (1.147)
где  . (1.148)
. (1.148)
Похоже будут выглядеть выражения для энтальпии и свободной энергии:
 , (1.149)
, (1.149)
 . (1.150)
. (1.150)
Здесь
 (1.151)
(1.151)
Величина μ i называется химическим потенциалом. Формулы (1.151), (1.148) и (1.146) дают его выражение при различных переменных, принятых за независимые.
Основываясь на выражении (1.145), можно записать первое и второе начала термодинамики для системы с переменным числом частиц:
 . (1.152)
. (1.152)
Химический потенциал является важной величиной, характеризующей равновесие фаз, состоящих из нескольких компонентов. Две фазы находятся в равновесии тогда, когда на их границе выполняются условия:
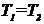 ,
,  ,
,  .
.
Не нашли, что искали? Воспользуйтесь поиском: