
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Термохимические расчеты
В термохимических расчетах применяют следствие из закона Гесса: тепловой эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
Для реакции: aA + bB = cC + dD
| DH х.р. = [сDH(C) + dDH(D)] - [aDH(A) + bDH(B)], | (8) |
где DH х.р. - тепловой эффект химической реакции;
a, b, c, d - стехиометрические коэффициенты;
DH(A) и DH(B) - теплоты (энтальпии) образования исходных веществ;
DH(C) и DH(D) - теплоты (энтальпии) образования продуктов реакции.
Для экзотермической реакции DHх.р. < 0, для эндотермической реакции DHх.р. > 0.
Изменение энтропии и изменение энергии Гиббса (по справочным данным) можно рассчитать по уравнения аналогичным (8):
| DS х.р. = [сDS(C) + dDS(D)] - [aDS(A) + bDS(B)], | (9) |
| DG х.р. = [сDG(C) + dDG(D)] - [aDG(A) + bDG(B)]. | (10) |
Особое значение при расчетах тепловых эффектов реакций имеют теплоты (энтальпии) образования соединений. Стандартная теплота (энтальпия) образования соединения - это количество теплоты, которое выделяется или поглощается при образовании одного моль химического соединения из простых веществ при стандартных условиях (температура 298 К, давление 101,3 кПа). Она измеряется в кДж/моль и обозначается DH0298 (иногда индексы опускаются и обозначают DH).
Стандартная теплота (энтальпия) образования простого вещества равна нулю.
Пример 1. Вычислите тепловой эффект химической реакции
2H2 + CO ® CH3OH(ж)
при 298 К и определите, насколько при этой температуре отличается DH и DU.
Решение
Тепловой эффект реакции равняется разности между суммой теплот образования конечных и суммой теплот образования начальных веществ. Поскольку стандартные теплоты образования  отнесены к 1 молю вещества, их умножают на соответствующие стехиометрические коэффициенты n уравнения реакции.
отнесены к 1 молю вещества, их умножают на соответствующие стехиометрические коэффициенты n уравнения реакции.
Решение задачи начинаем с выписывания справочных данных:
2H2 + CO ® CH3OH(ж)
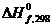 , кДж/моль 2 ´ 0 –110,53 –238,57
, кДж/моль 2 ´ 0 –110,53 –238,57
 = –238,57 – (–110,53) = –128,04 кДж.
= –238,57 – (–110,53) = –128,04 кДж.
Тепловой эффект реакции при постоянном объеме, или изохорный тепловой эффект  , можно найти из известного уравнения, связывающего изобарный и изохорный тепловые эффекты:
, можно найти из известного уравнения, связывающего изобарный и изохорный тепловые эффекты:

где: Dn - изменение числа молей газообразных веществ в результате реакции, вычисляемое по ее стехиометрическому уравнению.
Dn = – 2 – 1 = – 3 моль.
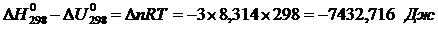 .
.
Пример 2. Вычислите DНо, DUо, DGо (энергию Гиббса), DFо (энергию Гельмгольца) для химической реакции:
2H2+ CO = CH3OH(г).
Определите, в каком направлении пойдет реакция при стандартном давлении и 298 К.
Решение
Энергию Гиббса будем рассчитывать по уравнению:
DG0298 = DH0298 - ТDS0298 ,
где DH0298 - тепловой эффект реакции при стандартных условиях и температуре Т=298 К.
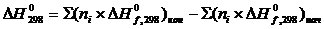
DS0298 - изменение энтропии в результате протекания реакции при стандартных условиях и температуре Т = 298 К. Для расчета DS0298 используют уравнение

где ni - число молей i-го вещества, соответствующее стехиометрическому коэффициенту перед этим веществом в уравнении реакции.
Энергию Гельмгольца будем рассчитывать по уравнению:
DF0298 = DG0298 - DnRT,
где: Dn - изменение числа молей газообразных веществ в результате реакции.
Решение задачи начинаем с выписывания справочных данных:
2H2 + CO ® CH3OH(г) (Dn =1–2–1= –2)
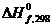 , кДж/моль 0 –110,53 –201,00
, кДж/моль 0 –110,53 –201,00
 2 ´ 130,52 197,15 239,76
2 ´ 130,52 197,15 239,76
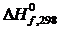 = –201,00 – 0 – (–110,53) = –90,47 кДж.
= –201,00 – 0 – (–110,53) = –90,47 кДж.
 .
.
 = 239,76 – 2 ´ 130,52 – 197,15 = –218,43 Дж/К.
= 239,76 – 2 ´ 130,52 – 197,15 = –218,43 Дж/К.
DG0298 = –90470 – 298´ (–218,43) = –25377,86 Дж.
DF0298 = –25377,86 – (–2) ´298´8,314 = –20422,66 Дж.
DG0298 < 0 и DF0298 < 0, следовательно реакция протекает в прямом направлении.
ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика изучает механизм и скорость реакций.
Средняя скорость гомогенной химической реакции (w) определяется изменением количества какого-либо из веществ, участвующих в реакции, в единицу времени (t) в единице объема (или изменением концентрации какого-либо вещества за единицу времени):
 . .
| (13) |
Факторы, влияющие на скорость химической реакции
Зависимость скорости химической реакции от концентрации подчиняется закону действия масс. Закон открыт Гульдбергом и Вааге (1876 г.). Согласно этому закону, мгновенная (истинная) скорость реакции пропорциональна произведению концентрации реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении лимитирующей стадии реакции. Частицы взаимодействуют при столкновении, а число столкновений молекул пропорционально произведению концентраций реагентов.
В реакции А + В = АВ, протекающей в закрытом сосуде, скорость взаимодействия веществ в соответствиис законом выражается уравнением:
| w = k ´ [А] ´ [В], | (14) |
где k – коэффициент пропорциональности, называемый константой скорости реакции, [А] и [В] – равновесные концентрации веществ А и В.
Константа скорости реакции зависит от температуры, природы вещества и не зависит от концентрации, то есть является мерой реакционной способности веществ. При концентрации реагирующих веществ, равных 1 моль/дм3, w = k, поэтому физический смыслконстанты скорости реакции – это скорость химической реакции при концентрациях реагентов 1 моль/дм3.
Если газообразные или жидкие вещества реагируют с твердыми, то скорость реакции зависит от концентрации веществ в газообразном или жидком состоянии, но не зависит от концентрации веществ в твердом состоянии, например, для реакции
Н2 (г) + S (тв) = Н2S (г) w = k ´ [Н2].
Скорость химических реакций, протекающих с участием газообразных веществ, зависит от давления. Если в системе увеличить давление путем сжатия, то объем системы уменьшится, концентрация взаимодействующих веществ увеличится, скорость реакции возрастет.
Влияние температуры на скорость реакции. Скорость химической реакции зависит от температуры. С увеличением температуры на 10 оС скорость большинства реакций возрастает в 2-4 раза (эмпирическое правило Вант–Гоффа).
Величина, показывающая, во сколько раз увеличивается скорость реакции при увеличении температуры на 10оС, называется температурным коэффициентом скорости реакции, обозначается γ (гамма). Величина γ меняется в пределах от 2 до 4.
Математическое выражение правила Вант – Гоффа:
 , ,
| (15) |
где w2 и w1 – скорость реакции при температуре t2 и t1 соответственно;
∆t = t2 – t1.
Увеличение скорости реакций с повышением температуры связано с увеличением скорости движения частиц и числа столкновений между ними. Однако расчеты показывают, что при нагревании реакционной системы от 273 К до 373 К (от 0 до 100 оС) число столкновений возрастет в  = 1,2 раза, а скорость реакции при γ = 2 увеличивается в 210 = 1024 раза. Следовательно, основная причина сильного влияния температуры на скорость в другом.
= 1,2 раза, а скорость реакции при γ = 2 увеличивается в 210 = 1024 раза. Следовательно, основная причина сильного влияния температуры на скорость в другом.
Не всякое соударение приводит к химическому взаимодействию. Реагируют лишь частицы, обладающие определенной энергией. Превращение одних веществ вдругие происходит через стадию образования некоторого активированного комплекса. Энергия, необходимая для перевода молекул в состояние активированного комплекса, называется энергией активации (Еакт). При соударении взаимодействуют лишь частицы, обладающие энергией большей или равной энергии активации. Для большинства реакций Еакт = 0 – 500, кДж/моль. При нагревании растет число активных частиц с Е ³ Еакт., увеличивается число эффективных столкновений и скорость реакции.
Зависимость константы скорости реакции k от энергии активации Еакт и температуры Т выражается уравнением Аррениуса (1889 г.):
 , ,
| (16) |
где Z – число столкновений в секунду в единице объема,
R – универсальная газовая постоянная (8,314 Дж/моль´К),
e – основание натурального логарифма (е =2,718),
T – температура по шкале Кельвина, К,
P – стерический фактор.
С уменьшением энергии активации и с увеличением температурывозрастает константа скорости реакции, а, следовательно, и скорость реакции.
Катализ
Явление изменения скорости процесса в присутствии некоторых веществ (катализаторов) называется катализом.
Катализатор – вещество, которое изменяет скорость реакции, активно в ней участвует, оставаясь после реакции химически неизменным.
Катализаторы или увеличивают скорость реакции (они называются активаторами или положительными катализаторами), или замедляют реакции (они называются ингибиторами или отрицательными катализаторами).
Например, в присутствии MnO2 (катализатор) наблюдается бурное разложение пероксида водорода: 2Н2О2 
 2H2O + O2.
2H2O + O2.
Если катализатор находится в той же фазе, что и реагирующие вещества, катализ называется гомогенным. Если катализатор и реагирующие вещества находятся в разных фазах – это гетерогенный катализ.
В присутствии катализатора образуется иной активированный комплекс с другой величиной энергии активации, что проводит к изменению скорости реакции.
Увеличение скорости реакции в присутствии катализатора связано с меньшей энергией активации нового пути процесса.
При гетерогенном катализе процесс протекает более сложно, т.к. промежуточные поверхностные соединения формируются на активных центрах (активных участках) катализатора, поэтому твердые катализаторы должны иметь большую (развитую) поверхность.
Основным законом химической кинетики является открытый в 1864–1867 гг. Гульдбергом и Вааге (Норвегия) закон действия масс, согласно которому скорость элементарной реакции пропорциональна произведению концентрацийреагирующих веществ в степенях, равных стехиометрическим коэффициентам. Такая зависимость скорости реакции от концентрации обусловлена тем, что вероятность столкновения молекул и, следовательно, их взаимодействия, пропорциональна произведению концентраций реагентов.
Рассмотрим в общем виде одностадийную обратимую реакцию, протекающую в гомогенной среде
А(г)+2В(г) Û АВ2(г)
Предположим, что в закрытом сосуде приведены в соприкосновение вещества А и В. Скорость взаимодействия этих веществ согласно закону действия масс выразится соотношением:
 =
=  [А][В]2
[А][В]2
где  – коэффициент пропорциональности – константа скорости прямой реакции,
– коэффициент пропорциональности – константа скорости прямой реакции,
[А] и [В] – равновесные молярные концентрации А и В.
Если же реакция протекает в гетерогенной системе, то скорость ее не зависит от концентрации твердого вещества, т. к. концентрация его постоянна, поэтому твердое вещество не входит в уравнение закона действующих масс.
В общем виде концентрацию обозначают буквой С.  – концентрация любого реагента (так как все они связаны стехиометрическими коэффициентами). Для идеального газа (условно при обычных условиях все газы приравнивают к идеальным) применимо уравнение Клапейрона-Менделеева:
– концентрация любого реагента (так как все они связаны стехиометрическими коэффициентами). Для идеального газа (условно при обычных условиях все газы приравнивают к идеальным) применимо уравнение Клапейрона-Менделеева:
РV = nRT.
РАСТВОРЫ
Растворами называются гомогенные системы, состоящие из двух или более компонентов и продуктов их взаимодействия. Растворение веществ в воде- это физико-химический процесс, при котором под влиянием молекул растворителя в растворенном веществе разрываются связи между частицами и образуются химические соединения растворяемого вещества и раствори-теля (сольваты и гидраты, если растворитель вода). Затем гидратированные частицы равномерно распределяются по всему объему раствора.
Растворение может быть как эндотермическим, так и экзотермическим процессом, поскольку разрушение структуры растворенного вещества происходит с поглощением определенного количества тепла (+ Н), а взаимодействие растворителя с частицами растворенного вещества сопровождается выделением тепла (- Н). В зависимости от того, какие процессы преобладают при растворении, тепловой эффект процесса положительный или отрицательный.
Способность вещества растворяться в данном растворителе характеризу-ется растворимостью. Растворимостью называется число, показывающее, сколько граммов растворенного вещества может раствориться в 100 г раст-ворителя при данной температуре. Растворимость вещества зависит от при-роды вещества, температуры, давления.
Одной из важнейших характеристик растворов является их концентрация.
Способы выражения концентраций:
1. Молярная концентрация – число молей растворенного вещества в 1 л раствора:
.
2. Нормальная концентрация – число эквивалентов растворенного вещества в 1 л раствора
3. Моляльная концентрация – показывает, сколько молей растворенного вещества содержится в 1 килограмме растворителя.
4. Массовая доля - число граммов вещества, содержащихся в 100г раствора.
Не нашли, что искали? Воспользуйтесь поиском: