
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
P-V диаграмма водяного пара

АЕ – зависимость уд. объема воды от давления при температуре 0 °С
АК – график зависимости уд. объема воды в сост. кипения или насыщения от давления (нижняя пограничная кривая) х=0 степень сухости пара.
КВ – график зависимости удельного объема сухого насыщенного пара от давления (верхняя пограничная линия)
В точке А' вода находится в состоянии кипения; С' – влажный пар; В' сухой насыщенный пар (вся вода превратилась в пар), D' – перегретый пар (относительно температуры насыщения при данном давлении). К – критическая точка в ней исчезает различие между жидкостью и паром. Существование вещества в двух фазном состоянии выше критической точки невозможно.
Для воды давление в критической точке 221,29 бар; температура 374,15 °С. Значение температуры в критической точке это абсолютная точка кипения жидкости (максимальная температура при которой возможен процесс кипения).
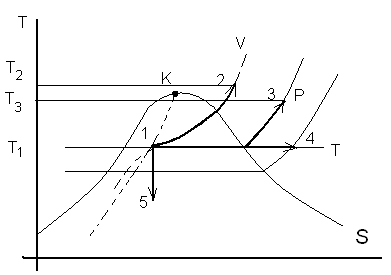
T-S диаграмма.
h – S диаграмма

Наиболее удобный метод расчетов процесса водяного пара – графический. Наносится нач. состояние пара по известным параметрам, проводится линия процесса и определяется параметр пара в конечной точке. При этом необходимо знать хотя бы два параметра в начальном состоянии и один в конечном.
1) Изохорный процесс (1-2 V=const) В изохорном процессе при подводе теплоты к влажному пару увеличивается его давление и температура.
Внешняя работа – работа изменения объема
L1-2= V1∫ V2 PdV=0; q1-2=ΔU1-2 (подводимая теплота расходуется на изменение внутренней энергии)
i=U+PV; U=i – PV; ΔU1-2= i2 – i1 – V(P2-P1)
Удельная техническая работа L'1-2=- P1∫P2 VdP = V(P1-P2)
2) Изобарный процесс (1-3 P=const)
Удельная техническая внеш. работа L'1-3=- ∫ VdP = 0
Уд. раб. измен-я объема L1-3= V1∫ V3 PdV= P(V3-V1)
Изменение внутренней энергии ΔU=U3-U1=i3-i1
При подводе теплоты в изобарном процессе к влажному пару степень сухости его растет, температура остается постоянной. Он переходит в сухой (Х=1), а при дальнейшем подводе теплоты в перегретый.
3) Изотермический процесс (1-4 Т= const)
Количество подведенной теплоты в изотермическом процессе можно определить через изменение q1-4=T·(S4-S1)
Изменение внутренней энергии и энтальпии равно нулю q1-4= L1-4= L'1-4
Для двух фазного состояния (0<X<1) влажный пар. При Т= const, Р так же постоянно. При этом меняется удельный объем, энтальпия, энтропия и внутренняя энергия.
L'=0 → Δi=q L = PΔV
4) Адиабатный процесс (1-5 dq=0).
dS=dq/T=0, S=const; S1=S5; L1-5=U1-U5; L'1-5= -Δi1-5=i1-i5
4, Цикл и схема парокомпрессионной холодильной установки.
 Схема:
Схема:
Не нашли, что искали? Воспользуйтесь поиском: