
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химическое равновесие. Рассмотрим как меняется энергия Гиббса веществ при равновесии химической реакции: аА(Г) bВ(Г).
Рассмотрим как меняется энергия Гиббса веществ при равновесии химической реакции: аА(Г)  bВ(Г).
bВ(Г).
Очевидно, что по мере расходования вещества А его энергия Гиббса будет уменьшаться, а энергия Гиббса конечного продукта будет возрастать. При достижении равновесия энергия Гиббса реакции станет равной нулю:
DGреакции =  DG продуктов реакции -
DG продуктов реакции -  DG исходных веществ = 0.
DG исходных веществ = 0.
Для рассматриваемой реакции:
DGреакции = b× GB - а× GА = 0
или а×GА = b×GB (24)
При равенстве энергий Гиббса продуктов реакции и исходных веществ движущая сила реакции исчерпана, и реакция останавливается, т.е. парциальные давления всех веществ становятся постоянными и не меняются как угодно долго (при данных условиях). Такое состояние химической системы называется состоянием химического равновесия. Установившиеся при этом парциальные давления веществ называются равновесными.
Запишем условие равновесия с учетом уравнений (20) и (24):
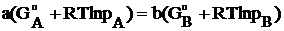 .
.
Для нашего случая:

 .
.
Размерность  - Дж или кДж.
- Дж или кДж.
Соотношение равновесных парциальных давлений  - величина для данных условий постоянная и называется константой равновесия (Кр):
- величина для данных условий постоянная и называется константой равновесия (Кр):
 .
.
Следовательно, можно записать, что:
 . (25)
. (25)
Константа равновесия равна отношению произведения равновесных парциальных давлений продуктов реакции и исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам веществ в рассматриваемой реакции.
Например, для реакции N2(Г) + 3H2(Г) 2 H3(Г) константа равновесия запишется как
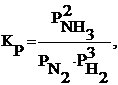
где р – равновесные относительные парциальные давления соответствующих веществ.
Константу равновесия можно рассчитать, объединяя уравнения (23) и (25):
 При перегруппировке членов этого уравнения получим уравнение:
При перегруппировке членов этого уравнения получим уравнение:
| |
 (26)
Из уравнения (26) видно, что КР для данной системы зависит только от температуры. При данной температуре это величина постоянная и не зависит от первоначальных количеств взятых для реакции веществ. (26)
Из уравнения (26) видно, что КР для данной системы зависит только от температуры. При данной температуре это величина постоянная и не зависит от первоначальных количеств взятых для реакции веществ.
| |
При использовании молярных концентраций веществ, участвующих в реакции, равновесие характеризуется концентрационной константой равновесия (КС), которая равна отношению произведений равновесных концентраций продуктов реакции и исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам веществ в рассматриваемой реакции.
Для реакции аA  bB bB
 где
где  и и  - равновесные молярные концентрации веществ А и В.
Рассмотрим взаимосвязь констант равновесия, выраженных через парциальные давления и концентрации. Если в объеме V находится nA молей вещества А и nB молей вещества В, то парциальные давления этих веществ будут равны соответственно: - равновесные молярные концентрации веществ А и В.
Рассмотрим взаимосвязь констант равновесия, выраженных через парциальные давления и концентрации. Если в объеме V находится nA молей вещества А и nB молей вещества В, то парциальные давления этих веществ будут равны соответственно:
 и и  ,
а равновесные концентрации: ,
а равновесные концентрации:
 и и  .
Исходя из уравнения состояния для идеального газа .
Исходя из уравнения состояния для идеального газа
 ,
получим: ,
получим:
 и и  .
Тогда .
Тогда  . .
| |
| Если все реагенты газообразны и их поведение подчиняется закону идеальных газов, то связь между КР и КС можно выразить уравнением: | |
КР = КС (RT) ∆v , (27)
где R – газовая постоянная, равная 0,082 л×атм/моль×К,
если давление выражено в атмосферах, а концентрация
в моль/л;
∆  – изменение числа молей газов в результате реакции: ∆
– изменение числа молей газов в результате реакции: ∆  = (b – а) - для приведенной выше реакции.
= (b – а) - для приведенной выше реакции.
Например, для реакции синтеза аммиака N2(Г) + 3H2(Г) 2 NH3(Г)
∆  = 2 – (1 + 3) = - 2 и КС = КР(RT) 2.
= 2 – (1 + 3) = - 2 и КС = КР(RT) 2.
Например, для рассмотренной выше реакции константа равновесия запишется как
 ,
,
где 

 - равновесные концентрации веществ, участвующих в реакции в моль/л.
- равновесные концентрации веществ, участвующих в реакции в моль/л.
Если реакция идет без изменения объема (количества молей газообразных веществ в результате реакции не меняется), или реакция протекает в растворе, то КР = КС.
Например, для реакции N2(Г) + O2(Г) 2 NO(Г), КР = КС.
Парциальные давления (концентрации) твердых веществ, принимающих участие в реакции, в выражение константы равновесия не включаются. Например, для реакции
MgCO3(тв)  MgO(тв) + CO2(Г),
MgO(тв) + CO2(Г),
КР =  , KС = [CO2]равн.
, KС = [CO2]равн.
Л И Т Е Р А Т У Р А
1. Глинка, Н.Л. Общая химия: учеб. / Н.Л. Глинка. – М.: КноРус, 2012.
2. Коровин, Н.В. Общая химия: учеб. / Н.В. Коровин. – изд. Академия, 2011, серия: Высшее профессиональное образование.
Вопросы для подготовки к семинару и экзамену
1. Статистические характеристики систем, состоящих из большого числа частиц. Понятие о функции состояния системы и основные свойства таких функций.
2. Первый закон термодинамики. Изобарные и изохорные процессы: внутренняя энергия и энтальпия как функция состояния системы. Стандартное состояние и стандартные значения энергии и энтальпии.
3. Стандартная энтальпия образования вещества. Зависимость энтальпии простого вещества от температуры и агрегатного состояния.
4. Расчет тепловых эффектов химических реакций. Законы Гесса и Лавуазье-Лапласа.
5. Термодинамическая вероятность как мера беспорядка в системе. Уравнение Больцмана. Энтропия как функция состояния системы и характер ее изменения при изменении основных параметров системы (агрегатное состояние, концентрация, объем, давление, температура).
6. Энергия Гиббса. Второй закон термодинамики: направление процесса и критерий равновесия системы. Связь константы химического равновесия с изменением энергии Гиббса. Влияние температуры на направление процесса.
Не нашли, что искали? Воспользуйтесь поиском: