
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Зависимость энтропии от температуры
С повышением температуры энтропия возрастает.
Действительно температура повышается за счет подвода теплоты (по мерее увеличения температуры становится возможным все большее число состояний, так как молекулы могут переходить в состояние со все более высокими значениями энергии, что приводит к увеличению термодинамической вероятности),  При постоянном давлении и небольшом изменении температуры (СР принимается постоянной) изменение энтропии системы можно выразить как, (см. уравнение 8):
При постоянном давлении и небольшом изменении температуры (СР принимается постоянной) изменение энтропии системы можно выразить как, (см. уравнение 8):
 (14)
(14)
Интегрируя это уравнение, получаем следующее выражение:
 (14а)
(14а)
На рис. 4. показан характер зависимости энтропии вещества от температуры. Как видно из рисунка 4, при фазовом переходе (ф.п.) вещества (из твердого состояния в жидкое, из жидкого в газообразное состояние) энтропия вещества скачкообразно возрастает, что связано с переходом в состояние с большей неупорядоченностью.
Изменение энтропии вещества при любых фазовых переходах (ф.п.) равно:
 . .
| (15) |
Зависимость энтропии вещества от температуры при постоянстве фазового состава определяется уравнением (14а).
В интервале умеренных температур (300 - 500К) этим изменением при ориентировочных расчетах часто пренебрегают.
Уравнение температурной зависимости энтропии 1 моля вещества в пределах одного фазового состояния:
 , (16)
, (16)
где Ср – мольная теплоемкость при р = const.

Рис. 4. Зависимость энтропии вещества от температуры.
Принимая Ср = const в интервале температур Т1 и Т2 получаем
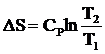 . (17)
. (17)
Обратите внимание, что зависимость на рис.4 выходит из начала координат. При температуре равной абсолютному нулю тепловое движение отсутствует, все атомы в идеальном кристалле занимают строго определенные места в пространстве. Такое состояние системы может быть реализовано единственным способом, поэтому при этом W = 1, а S = 0. Это третий закон термодинамики, называемый также постулатом Планка.
Не нашли, что искали? Воспользуйтесь поиском: