
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Работа газа при изменении его объема
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис.7.1).
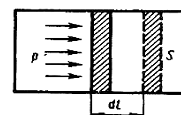 Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние d l, то производит над ним работу
Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние d l, то производит над ним работу
δA=Fdl=pSdl=p dV,
где S — площадь поршня, Sdl=dV — изменение
Рис.7.1 объема системы. Таким образом,
δA=p dV (7.7)
Полную работу А, совершаемую газом при изменении его объема от V 1до V 2 найдем интегрированием формулы (7.7):
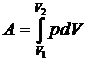 (7.8)
(7.8)
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение справедливо при любых изменениях объема твердых, жидких и газообразных тел.

Рис.7.2
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Пусть изменение давления газа при его расширении от объема V 1 до объема V 2 изображается кривой на рис.7.2.
При увеличении объема на dV совершаемая газом работа равна pdV,т. е. определяется площадью полоски с основанием dV,заштрихованной на рис.7.2. Поэтому полная работа, совершаемая газом при расширении от объема V 1до объема V 2 определяется площадью, ограниченной осью абсцисс, кривой p=f (V)и прямыми V 1и V 2.
Графически можно изображать только равновесные процессы – процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
Теплоемкость
Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
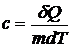 (7.9)
(7.9)
Единица удельной теплоемкости — джоуль деленный на килограмм-кельвин (Дж/(кг×К)).
Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
Cm= 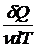 ,(7.10)
,(7.10)
где: v=m/M – количество вещества.
Единица молярной теплоемкости — джоуль деленный на моль·кельвин (Дж/(моль·К)). Удельная теплоемкость с связана с молярной Сm соотношением
Сm = сМ (7.11)
Различают молярные теплоемкости при постоянном объеме СV и постоянном давлении Ср, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Запишем выражение первого начала термодинамики (7.6) для 1 моля газа
CmdT = dUm + pdVm. (7.12)
Молярная теплоемкость газа при постоянном объеме СV равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К
CV =iR/ 2 (7.13)
Молярная теплоемкость при постоянном давлении:
Сp = СV+R (7.14)
Выражение (7.14) называется уравнением Майера; оно показывает, что Ср всегда больше СV на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа.
Сp=  (7.15)
(7.15)
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Ср к СV:
 (7.16)
(7.16)
Из формул следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры.
Не нашли, что искали? Воспользуйтесь поиском: