
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Функции био мембран. Хар-ка мембранных белков и липидов, их функции. Подвижность липидных компонентов в мембране.
37. Потребность человека в белках. Незаменимые АК. Био ценность белков. Роль белков в питании. В нашем организме идёт постоянный синтез и распад белков. Ежесуточно распадается 400гр. белка и столько же синтезируется. Из общей массы организма белка приходится 15кг. Синтез обновленного белка происходит из аминокислот, которые образуются при распаде.
Все АК можно разделить на 4 группы:
1.Заменимые - синтезируются в организме: АЛА, АСП, АСН, ГЛУ, ГЛН, ГЛИ, ПРО, СЕР.
2.Незаменимые - не синтезируются в организме и поступают с пищей: ВАЛ, ЛЕЙ, ИЛЕ. ЛИЗ. ТРЕ, МЕТ, ФЕН, ТРИ.
3.Частично заменимые - синтезируются в организме, но очень медленно и не покрывают всех потребностей организма: ГИС, АРГ.
4.Условно заменимые - синтезируются из незаменимых аминокислот: ЦИС (МЕТ), ТИР (ФЕН). Полноценность белкового питания определяется:
1. Наличием всех незаменимых аминокислот. Отсутствие даже одной незаменимой аминокислоты нарушает биосинтез белка, т.е. каждая незаменимая АКьможет быть лимитирующей в процессе синтеза белка.
2. Аминокислотным составом белка. Все АК могут содержаться в продуктах как животного, так и растительного происхождения. Суточная потребность человека в белках составляет 100гр.
38. Превращение белков в желудке. Роль соляной кислоты в переваривании белков. Показать действие пептидгидролаз. Пищевые белки подвергаются гидролитическому расщеплению под действием целой группы ферментов ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ (ПЕПТИДАЗЫ). Большинство этих ферментов вырабатывается в неактивной форме, т.е. в форме ПРОФЕРМЕНТОВ, а затем активируется путём ЧАСТИЧНОГО ПРОТЕОЛЗА. Это предохраняет стенки органов ЖКТ от само переваривания. Поверхность желудка и кишечника покрыта слизью, в составе которой содержаться ГЕТЕРОПОЛИСАХАРИДЫ. Они не подвергаются действию ферментов. Проферменты вырабатываются слизистой желудка или кишечника и поступают в полость этих органов, где происходит их активация. В пристеночном слое вырабатываются БИКАРБОНАТЫ, которые создают среду близкую к нейтральной (рН=5-6). В ротовой полости белки не подвергаются каким-либо химическим превращениям, т.к. здесь отсутствуют ферменты, действующие на белки. Здесь происходит лишь механическая переработка пищи. В желудке начинается химическое превращение белков. Здесь действуют два основных фермента: ПЕПСИН и ГАСТРИКСИН.
ПЕПСИН вырабатывается главными клетками слизистой желудка в неактивной форме -ПЕПСИНОГЕН, который под действием соляной кислоты активируется и превращается в пепсин. Процесс активации является АУТОКАТАЛИТИЧЕСКИМ. ПЕПСИНОГЕН активируется очень медленно, а пепсин потом становится активатором молекул ПЕПСИНОГЕНА. От ПЕПТИДНОЙ цепи неактивного ПЕПСИНОГЕНА со стороны N-конца отрывается один ПЕПТИД, содержащий 42 аминокислоты - активация путём ЧАСТИЧНОГО ПРОТЕОЛИЗА. Затем из остатка цепи формируется новая трёхмерная структура фермента - пепсина и новый активный центр. Соляная кислота вырабатывается обкладочными клетками слизистой желудка и играет очень важную роль в переваривании белков:
активирует ПЕПСИНОГЕН, превращая его в пепсин, создаёт оптимум рН для действия пепсина (1,5 - 2), обладает бактерицидным действием, денатурирует белки, которые потом гидролизуются. Внутренние ПЕПТИДНЫЕ связи становятся доступными для действия пепсина, способствует продвижению желудочного содержимого далее в кишечник. Пепсин - это фермент, который является ЭНДОПЕПТИДАЗОЙ, т.е. действует на внутренние ПЕПТИДНЫЕ связи, в образовании которых участвуют ароматические аминокислоты (ФЕН, ТИР, ТРИ) своими АМИДНЫМИ группами. ГАСТРИКСИН по действию аналогичен пепсину. Это тоже ЭНДОПЕПТИДАЗА. Его оптимум рН = 3 - 3,5. Действует на ПЕПТИДНЫЕ связи, в образовании которых участвуют ДИКАРБОНОВЫЕ аминокислоты (ГЛУ, АСП) своими КАРБОКСИЛЬНЫМИ группами. В желудке под действием ПЕПСИНА и ГАСТРИКСИНА сложные белковые молекулы распадаются на высокомолекулярные ПОЛИПЕПТИДЫ. Ими являются так называемые АЛЬБУМОЗЫ, ПЕПТОНЫ, которые поступают в тонкий кишечник.
39. Переваривание белков в кишечнике. Показать действие трипсина и химотрипсина на конкретных примерах. В тонком кишечнике эти ПОЛИПЕПТИДЫ подвергаются действию целого ряда протеолитических ферментов ПЖЖ, которые вырабатываются в неактивной форме: ТРИПСИНОГЕН, ХИМОТРИПСИНОГЕН, ПРОЭЛАСТАЗА, ПРОКАРБОКСИПЕПТИДАЗА.
Механизм активации всех этих ферментов – ЧАСТИЧНЫЙ ПРОТЕОЛИЗ по каскадному механизму.

ТРИПСИН, ХИМОТРИПСИН, ЭЛАСТАЗА - ЭНДОПЕПТИДАЗЫ.
ТРИПСИН разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие ЛИЗ и АРГ. ХИМОТРИПСИН разрушает внутренние связи, в образовании которых принимают участие ароматические аминокислоты (ТИР, ТРИ, ФЕН). ЭЛАСТАЗА разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие АЛА, ГЛИ, ПРО, ЦИС. В результате действия ПЕПСИНА, ХИМОТРИПСИНА и ЭЛАСТАЗЫ высокомолекулярные ПЕПТИДЫ расщепляются до низкомолекулярных, которые подвергаются действию ЭКЗОПЕПТИДАЗ, действующих на крайние связи, отщепляя отдельные концевые аминокислоты. КАРБОКСИПЕПТИДАЗА разрушает крайние связи, отщепляя аминокислоты с С-конца. АМИНОПЕПТИДАЗА действует на крайние ПЕПТИДНЫЕ связи со стороны N-конца, отщепляя отдельные аминокислоты. ДИПЕПТИДЫ подвергаются действию ДИПЕПТИДАЗ, продуцирующихся слизистой кишечника сразу в активной форме. Т.о. в результате действия всей этой группы ферментов в ЖКТ белки пищи расщепляются до аминокислот. Образующиеся аминокислоты всасываются стенкой кишечника в кровь и поступают во все органы и ткани.
40. Гниение белков и Ак в кишечнике. Пути образования продуктов гниения. Примеры. Не всосавшиеся аминокислоты поступают в толстую кишку, где подвергаются процессам гниения. Это процесс бактериального распада веществ под действием микрофлоры или ферментов, вырабатывающихся этой микрофлорой. В норме в толстой кишке подвергаются аминокислоты, а при патологии - белки. Это происходит и в других отделах ЖКТ: в желудке (при понижении кислотности), ротовой полости (при кариесе).

1.РЕАКЦИЯ ДЕКАРБОКСИЛИРОВАНАЯ.
А ОРНИТИН в состав белков не входит, но обязательно содержится в организме

В. ЛИЗИН

ПУТРЕСЦИН и КАДАВЕРИН являются токсическими веществами. Они входят в состав трупных
ядов.
2.ВОССТАНОВИТЕЛБНОЕ ДЕЗАМИНИРОВАНИЕ.

З.ДЕСУЛЬФИРОВАНИЕ - восстановительный процесс.

4.распад боковой цепи циклических аминокислот.


Все эти вещества токсические, образующиеся при гниении поступают в печень, где и происходит их обезвреживание.
42. Механизм обезвреживания продуктов гниения белков. Роль ФАФС и УДФ-ГК в этом процессе (конкретные примеры). В печени имеется две системы, участвующие в обезвреживании этих веществ:
1. УДФГК - УРИДИНДИФОСФОГЛЮКУРОНОВАЯ К-ТА.
2. ФАФС - ФОСФОАДЕНОЗИНФОСФОСУЛЬФАТ.
Процесс обезвреживания - это процесс конъюгации токсических веществ с одной из этих систем и образование конъюгатов, которые являются уже нетоксическими веществами.

Индол предварительно подвергается ГИДРОКСИЛИРОВАНИЮ.

ИНДОКСИЛСУЛЬФАТ нейтрализуется и превращается в натриевую или калиевую соль.

Все эти вещества выводятся из организма с мочой. В норме реакция на индол должна быть отрицательна. При положительной реакции на индол - нарушена детоксикационная функция печени. Положительная реакция на ИНДИКАН наблюдается при очень активном гниении белков в толстом кишечнике.
43. Переаминирование и декарбоксилирование АК. Химизм процессов, хар-ка ферментов и коферментов. Образование амидов. Часть аминокислот в тканях подвергается различным метаболическим превращениям.
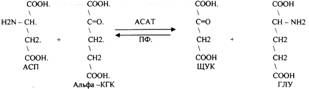
1. Основной путь превращения аминокислот в тканях - это реакции ПЕРЕАМИНИРОВАНИЯ -реакции между АМИНО- и КЕТОКИСЛОТАМИ, когда они обмениваются своими функциональными группами, при этом аминокислоты являются донорами аминогрупп, а кетокислоты - их акцепторами. Эти реакции катализирует фермент - АМИНОТРАНСФЕРАЗА. Она локализуется в МИТОХОНДРИЯХ и ЦИТОПЛАЗМЕ. ТРАНСАМИНИРОВАНИЮ могут подвергаться все аминокислоты кроме ЛИЗ и ТРЕ. В организме человека обнаружено 10 различных АМИНОТРАНСФЕРАЗ. Наибольшее значение имеют AT, донорами аминогрупп которых являются АЛА, АСП, ГЛУ. ГЛУТАМИНОВАЯ кислота является универсальным донором, а альфа -КГК - универсальным акцептором аминогрупп.
Роль реакций ТРАНСАМИНИРОВАНИЯ:
1. используются для синтеза заменимых аминокислот. При этом происходит перераспределение азота в органах и тканях.
2. Является начальным этапом катаболизма аминокислот
3. В результате ТРАНСАМИНИРОВАНИЯ образуются альфа -КЕТОКИСЛОТЫ, которые поступают в ЦТК и включаются в ГЛЮКОНЕОГЕНЕЗ.
4. Протекают в разных тканях, но более всего в печени. Определение активности AT имеет диагностическое значение в клинике. АСАТ наиболее активна в миокарде, следовательно, повышение в сыворотке крови АСАТ можно предположить патологию в сердечной мышце. АЛАТ (АЛАНИНОВАЯ AT) особенно активна в печени, следовательно, повышение её в сыворотке крови свидетельствует о деструктивных изменениях в печени. При избытке АЛАНИНА или недостатке АСПАРАГИНОВОЙ К-ТЫ:
1. АЛА + альфа-КГК ↔ ГЛУ + ПВК
2. ГЛУ + ЩУК ↔АСП + альфа-КГК
2.Реакции ДЕКАРБОКСИЛИРОВАНИЯ - разрушение СООН-группы с выделением СО2. При этом аминокислоты в тканях образуют биогенные амины, которые являются биологически активными веществами (БАВ). Среди них могут быть соединения, которые выполняют функции:
1. НЕЙРОМЕДИАТОРОВ (СЕРЕТОНИН, ДОФАМИН, ГАМК),
2. Гормоны (АДРЕНАЛИН, НОРАДРЕНАЛИН),
3. Регуляторы местного действия (ГИСТАМИН).

ГАМК является НЕИРОМЕДИАТОРОМ тормозного действия, поэтому препараты на основе ГАМК используются в клинике для лечения некоторых заболеваний ЦНС. Эта реакция используется в педиатрической практике: детям при сильном возбуждении используют раствор витамина В6, который стимулирует процесс образования ГАМК. ДОФАМИН является НЕИРОМЕДИАТОРОМ возбуждающего действия. Он является основой для синтеза АДРЕНАЛИНА и НОР АДРЕНАЛИНА.

ГИСТАМИН повышает секрецию желудочного сока, поэтому применяется в клинической практике при зондировании. Обладает сосудорасширяющим действием, понижает АД.

44. Дезаминирование АК. Виды дезаминирования. Окислительное дезаминирование. Непрямое дезаминирование АК на примере тирозина. Реакции ДЕЗАМИНИРОВАНИЯ - разрушение NН2-группы с выделением аммиака. В организме возможны следующие виды ДЕЗАМИНИРОВАНИЯ.
1. Восстановительное

2.ГИДРОЛИТиЧЕСКОЕ:

3. Внутримолекулярное:

Эти три вида ДЕЗАМИНИРОВАНИЯ имеют место при гниении, т.е. идут в толстой кишке.
4. Окислительное. Протекает в клетке. Непосредственно, ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергается только ГЛУ..
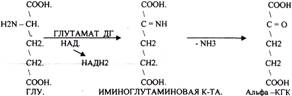
ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергаются и другие аминокислоты, но этот путь является непрямым. Он идёт через ГЛУ и называется процессом НЕПРЯМОГО ОКИСЛИТЕЛЬНОГО ДЕЗАМИНИРОВАНИЯ. Аммиак образуется из аминокислот при распаде других азотсодержащих соединений (биогенных аминов, НУКЛЕОТИДОВ). Значительная часть аммиака образуется в толстой кишке при гниении. Он всасывается в кровь системы воротной вены, здесь концентрация аммиака больше, чем в общем кровотоке.
Аммиак образуется в различных тканях. Концентрация его в крови незначительна, т.к. он является токсичным веществом (0,4 - 0,7мг/л). Особенно выраженное токсическое действие он оказывает на нервные клетки, поэтому значительное его повышение приводит к серьёзным нарушениям обменных процессов в нервной ткани.
45. Синтез мочевины (орнитиновый цикл), последовательность р-ций. Гиперазотемия. Диагностическое значение определения креатинина в сыворотке крови. Синтез мочевины - основной путь обезвреживания аммиака - ОРНИТИНОВЫЙ ЦИКЛ.
КАРБОМОИЛФОСФАТ



АРГИНАЗА обладает абсолютной специфичностью и содержится только в печени. В составе
мочевины содержится два атома азота: один поступает из аммиака, а другой выводится из АСП.
Образование мочевины идёт только в печени.
Две первые реакции цикла (образование ЦИТРУЛЛИНА и АРГИНИНОСУКЦИНАТА) идут в
МИТОХОНДРИЯХ, остальные в цитоплазме.
В организме в сутки образуется 25гр мочевины. Этот показатель характеризует мочевино-
образующую функцию печени. Мочевина из печени поступает в почки, где и выводится из
организма, как конечный продукт азотистого обмена.
46. Особенности обмена нуклеотидов. Их строение и распад. Образование мочевой к-ты. Подагра. ОСОБЕННОСТИ МЕТАБОЛИЗМА НУКЛЕОТИДОВ.
1. Нуклеотиды и азотистые основания (ао), поступающие с пищей, не включаются в нуклеотиды и нуклеиновые к-ты организма.
2. Клетки организма человека синтезируют предшественники НУКЛЕОТИДОВ. Исходя из этого, доказательств опасности употребления в пищу генно-инженерных продуктов в настоящий момент нет.
3. Помимо синтеза включаются механизмы реутилизации ПУРИНОВЫХ и ПИРИМИДИНОВЫХ оснований, образующихся при деградации нуклеиновых кислот.
4. Можно использовать аналоги ПУРИНОВ и ПИРИМИДИНОВ как антиканцерогенные вещества путём включения их в ДНК и РНК.
БИОСИНТЕЗ ПУРИНОВЫХ ОСНОВАНИЙ. Для биосинтеза ПУРИНОВЫХ оснований доносами атомов и атомных групп являются:

Для биосинтеза ПИРИМИДИНОВЫХ оснований донорами атомов и атомных групп являются АСП, ГЛУ, производные ФОЛИЕВОЙ кислоты. Распад НП происходит одинаково и в тканях, и в ЖКТ.

Окисление мочевой кислоты - окисление ПУРИНОВЫХ НУКЛЕОЗИДОВ.



Мочевая кислота является конечным продуктом распада ПУРИНОВЫХ НУКЛ.

Уровень мочевой кислоты будет свидетельствовать об интенсивности распада ПУРИНОВЫХ оснований тканей организма и пищи. При распаде ПИРИМИДИНОВЫХ оснований из них образуется:
l.B-аланин СО2 NH3 МОЧЕВИНА
 |  |
2.бета -АМИНОИЗОБУТИРАТ.
НАРУШЕНИЕ ОБМЕНА НУКЛЕОТИДОВ.
ГИПЕРУРИКЕМИЯ - повышение уровня мочевой кислоты в крови указывает на повышенный распад нуклеиновых кислот или пуриновых нуклеотидов. Мочевая кислота плохо растворима и выпадает в кристаллы в кислой среде. Развивается подагра, артриты, инициируется развитие МКБ (моче каменной болезни). В этих случаях рекомендуется содовое питьё. Образуются УРАТЫ натрия, которые являются растворимыми и легко выводятся из организма.
47. Основные проявления патологии обмена белков на различных его этапах. ПАТОЛОГИЯ БЕЛКОВОГО ОБМЕНА.
1. Нарушение на этапе поступления белков. В норме в организм должно поступать 80 – 100гр белков. Обязательно поступление всех незаменимых АК.
Клинические проявления при недостатке определённых АК:
Лизин -тошнота, глаукома, повышение чувствительности к шуму: ГИС - понижение гемоглобина; МЕТ - жировая инфильтрация печени и почек.
При общем белковом голодании развивается белковая недостаточность, которая проявляется понижением уровня белка в сыворотке крови, ГИПОПРОТЕИН- и ГИПОГЛОБУЛИНЕМИЕЙ. Понижается онкотическое давление, и вода устремляется в ткани (развиваются отёки).
2. Нарушение на этапе пищеварения:
A) в желудке: ГИПОАЦИДОЗ, следовательно, пепсин неактивен и нарушается распад белков;
АХЛОРГИДРИЯ, следовательно, белки не расщепляются в желудке, подвергаются гниению.
B) в тонком кишечнике:
Связан с поражением ПЖЖ (панкреатиты), следовательно, недостаточность выработки трипсина и других гидролитических ферментов.
C) в толстой кишке:
Запоры, непроходимость, следовательно, усиление процессов гниения.
3. Нарушение МЕЖУТОЧНОГО обмена - нарушение обмена аминокислот в тканях.
A) Приобретенные - часто связаны с отсутствием витаминов (г.о. В6), следовательно, нарушение процессов ПЕРЕАМИНИРОВАНИЯ, ДЕЗАМИНИРОВАНИЯ. Это приводит к гиперацидоаминемии, аминоацидурии.
B) Наследственные. Чаще всего встречаются нарушения обмена ФЕНИЛАЛАНИНА. В норме ФЕН трансформируется в ТИР.

Отсутствие ФАГ приводит к так называемому метаболическому блоку.

Эти соединения накапливаются в тканях, повышаются в крови, появляются в моче -
ФЕНИЛКЕТОНУРИЯ (ФКУ). Они токсичны, особенно для тканей мозга. Ребёнок отстаёт в умственном развитии ФЕНИЛПИРОВИНОГРАДНАЯ ОЛИГОФРЕНИЯ. Назначается специальная диета, исключающая ФЕНИЛАЛАНИН.
При нарушении метаболизма ТИРОЗИНА не синтезируется МЕЛАНИН, следовательно, нарушается пигментация кожи, радужки. Моча окрашивается в бурый цвет, а затем в чёрный - АЛКАПТОНУРИЯ.
Нарушение на стадии ОРНИТИНОВОГО ЦИКЛА, следовательно накопление промежуточных продуктов (ЦИТРУЛИНА, АРГИНИНСУКЦИНАТА) ЦИТРУЛЛИНУРИЯ, АРГИНИНСУКЦИНАТНОЕ СЛАБОУМИЕ.
Нарушение на уровне выведения конечных продуктов. ЦИСТИНОЗ - нарушение РЕАБСОРБЦИИ АК и повышение их экскреции в 5 -10 раз (ЦИСТИН, ЦИСТЕИН).
48. Нарушения обмена АК при дефиците витаминов (написать примеры р-ций). Приобретенные - часто связаны с отсутствием витаминов (г.о. В6), следовательно, нарушение процессов ПЕРЕАМИНИРОВАНИЯ, ДЕЗАМИНИРОВАНИЯ. Это приводит к ГИПЕРАЦИДОАМИНЕМИИ, АМИНОАЦИДУРИИ.
49. Генетические дефекты обмена АК. Наследственные. Чаще всего встречаются нарушения обмена ФЕНИЛАЛАНИНА. В норме ФЕН трансформируется в ТИР.

Отсутствие ФАГ приводит к так называемому метаболическому блоку.

Эти соединения накапливаются в тканях, повышаются в крови, появляются в моче -
ФЕНИЛКЕТОНУРИЯ (ФКУ). Они токсичны, особенно для тканей мозга. Ребёнок отстаёт в умственном развитии ФЕНИЛПИРОВИНОГРАДНАЯ ОЛИГОФРЕНИЯ. Назначается специальная диета, исключающая ФЕНИЛАЛАНИН.
При нарушении метаболизма ТИРОЗИНА не синтезируется МЕЛАНИН, следовательно, нарушается пигментация кожи, радужки. Моча окрашивается в бурый цвет, а затем в чёрный - АЛКАПТОНУРИЯ.
51. Современные представления о структурно-функциональной организации ДНК: генная (структурные, регуляторные элементы ДНК) и негенная (тандемные повторы, псевдогены, мобильные элементы ДНК) области. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О СТРУКТУРНО-ФУНКЦИОНАЛЬНОЙ ОРГАНИЗАЦИИ ДНК. 95% ДНК человека представляет не генная часть. 5% - собственно гены. Не генная часть представлена:
1. ТАНДЕМНЫЕ ПОВТОРЫ монотонные повторы НУКЛЕОТИДОВ, как правило дуплетного характера, не имеющие смысла. Это так называемые «пустынные участки» ДНК. В настоящее время смысл этих участков: выполнение структурной функции и площадки для образования генов в эволюции (эволюционный резерв).
2. ПСЕВДОГЕНЫ - неактивные, но стабильные генетические элементы, возникающие в результате мутации в ранее работавших генах (гены, выключенные мутацией). Это побочный продукт и генетический резерв эволюции. Составляют 20 - 30% не генной части ДНК.
3. Мобильные генетические элементы:
-ТРАНСПОЗОНЫ - участки ДНК, способные вырезаться и встраиваться в другие области ДНК. Это так называемые «странники генов».
-РЕТРОТРАНСПОЗОНЫ - участки ДНК, копирующиеся в пределах генома, как внутри хромосомы, так и между ними. Могут изменять смысл структурных генов человека, приводят к мутациям. Геном человека изменяется в течении жизни на 10 - 30%.
- поврежденные неактивные, мобильные генетические элементы. Не могут ни вырезаться, ни встраиваться из-за отсутствия в клетке ОБРАТНОЙ ТРАНСФЕРАЗЫ. Если фрагмент поступает в клетку с вирусом, то тогда эти гены начинают транскрибироваться. ФУНКЦИОНАЛЬНЫЕ ЭЛЕМЕНТЫ ГЕНОМА:
1. СТРУКТУРНЫЕ ГЕНЫ
2. РЕГУЛЯТОРНЫЕ ЭЛЕМЕНТЫ
Структурные гены кодируют синтез МРНК, ТРНК, РРНК.
Регуляторные элементы не кодируют РНК и, соответственно, белков; влияют на работу
структурных генов.
ГЕНОМИКА - отрасль молекулярной биологии, изучающая структуру и механизмы работы гена. В настоящее время установлено и изучено 35000 генов человека. Из них в каждой клетке работает 25%.
53. Механизмы репликации ДНК (матричный принцип, полуконсервативный способ). Генетическая догма: информация записана в ДНК и передаётся на дочерние молекулы ДНК из поколения в поколение с помощью процесса репликации.
ДНК ® РНК ® белок
РЕПЛИКАЦИЯ - процесс самоудвоения ДНК. Этот процесс стал полностью изучен только после того, как УОТСОН и КРИК предложили структуру ДНК в виде двойной спирали, полинуклеотидные цепи которой связаны комплиментарными, азотистыми основаниями (А:::Т, Г:::Ц). Если азотистые основания комплиментарны друг другу, то и полинуклеотидные цепи тоже комплиментарны. В основе механизма репликации лежит принцип комплиментарности. К механизму репликации относится матричный биосинтез. Репликация ДНК идёт полуконсервативным способом: на каждой материнской полинуклеотидной цепи синтезируется дочерняя цепь.
54. Условия, необходимые для репликации. Условия необходимые для репликации:
1. Матрица - нити ДНК. Расщепление нити называется РЕПЛИКАТИВНАЯ ВИЛКА. Она может образовываться внутри молекулы ДНК. Они движутся в разных направлениях, образуя РЕПЛИКАТИВНЫЙ ГЛАЗОК. Таких глазков в молекуле ДНК ЭУКАРИОТ несколько, каждый имеет две вилки

2. Субстрат. Пластическим материалом являются ДЕЗОКСИНУКЛЕОТИДТРИФОСФАТЫ:
дАТФ, дГТФ, дЦТФ, дТТФ. Затем происходит их распад до ДЕЗОКСИНУКЛЕОТИДМОНОФОСФАТОВ, двух молекул фосфата неорганического с выделением энергии, т.е. они одновременно являются источником и энергии, и пластического материала.
Д-АТФ® Д-АМФ + ФФ + Е.
3. Ионы магния.
4. Репликативный комплекс ферментов:
5. ПРАЙМЕРЫ - «затравка» для репликации. Это короткий фрагмент, состоящий из РИБОНУКЛЕОТИДТРИФОСФАТОВ (2 - 10). Образование ПРАИМЕРОВ катализируется ПРАЙМАЗОЙ.
55. Репликативный комплекс (хеликаза, топоизомераза). Праймеры и их роль в репликации. Репликативный комплекс ферментов:
A) ДНК -раскручивающие белки:
1. DNA-A (вызывает расхождение нитей)
2. ХЕЛИКАЗЫ (расщепляют цепь ДНК)
3. ТОПОИЗОМЕРАЗЫ 1 и 2 (раскручивают сверх спирали). Разрывают (3',5') - фосфодиэфирные связи. ТОПОИЗОМЕРАЗА 2 у ПРОКАРИОТ называется ГИРАЗА.
B) Белки, препятствующие соединению нитей ДНК (SSB -белки)
C) ДНК-ПОЛИМЕРАЗА (катализирует образование фосфодиэфирных связей). ДНК- ПОЛИМЕРАЗА только удлиняет уже существующую нить, но не может соединить два свободных НУКЛЕОТИДА.
D) ПРАЙМАЗА (катализирует образование «затравки» к синтезу). Это по своей структуре РНК-ПОЛИМЕРАЗА, которая соединяет одиночные НУКЛЕОТИДЫ.
Е)ДНК-ЛИГАЗА.
ПРАЙМЕРЫ - «затравка» для репликации. Это короткий фрагмент, состоящий из РИБОНУКЛЕОТИДТРИФОСФАТОВ (2 - 10). Образование ПРАИМЕРОВ катализируется ПРАЙМАЗОЙ.
56. Основные этапы репликации. Инициация репликации. Образование дочерних нитей ДНК. Фрагменты Оказаки. Основные этапы репликации.
1.ИНИЦИАЦИЯ репликации.
Происходит под влиянием внешних стимулов (факторов роста). Белки соединяются с рецепторами на плазматической мембране и вызывают репликацию в синтетическую фазу клеточного цикла. Смысл инициации заключается в присоединении в точку репликации DNA-A, стимулирующего расхождение двойной спирали. В этом принимает участие и ХЕЛИКАЗА. Действуют ферменты (ТОПОИЗОМЕРАЗЫ), вызывающие раскручивание сверх спирали. SSB-белки препятствуют соединению дочерних цепей.
Образуется РЕПЛИКАТИВНАЯ ВИЛКА.
Образование дочерних нитей.
Этому предшествует образование ПРАИМЕРОВ с помощью фермента ПРАЙМАЗЫ. Действует ДНК-ПОЛИМЕРАЗА и образуется дочерняя нить ДНК. Этот процесс происходит в соответствии с принципом комплиментарности, и синтез идёт от 5' к 3' концу синтезируемой нити.

На одной из материнских нитей будет строиться непрерывная цепь, а на противоположной нити - цепь из коротких фрагментов (фрагментов ОКАЗАКИ) Удаление ПРАИМЕРОВ с помощью ЭКЗОНУКЛЕАЗЫ.
Соединение коротких фрагментов с помощью ДНК-ЛИГАЗЫ.
Дочерние нити КОМПЛИМЕНТАРНЫ материнским. Дочерние молекулы ДНК являются копией материнской ДНК. Значение репликации: воспроизведение генотипа в поколениях.
2. РЕПАРАЦИЯ ДНК.
ДНК человека содержит примерно 3 млрд. НУКЛЕОТИДОВ. Если появится одна ошибка на 1млн. НУКЛЕОТИДОВ, то в целом в молекуле ДНК будет 3000 ошибок за один процесс репликации. Ошибки в репликации могут привести к летальному исходу. В организме существует система, исправляющая ошибки - система репарации ДНК. Она состоит из трёх ферментов:
- ЭНДОНУКЛЕАЗА,
- ЭКЗОНУКЛЕАЗА,
- ДНК-ПОЛИМЕРАЗА РЕПАРИРУЮЩАЯ.
- ЭНДОНУКЛЕАЗА вызывает разрыв фосфодиэфирных связей повреждённого НУКЛЕОТИДА с соседним, с той или с другой стороны. В результате образуется два конца. В действие вступает ЭКЗОНУКЛЕАЗА, отщепляющая НУКЛЕОТИДЫ с образующихся концов ДНК в обе стороны. В результате действия этих ферментов на одной нити ДНК возникает дефект. В работу вступает ДНК-ПОЛИМЕРАЗА РЕПАРИРУЮЩАЯ. Она достраивает повреждённую цепь в соответствии с принципом комплиментарности. Т.о. повреждённый НУКЛЕОТИД удаляется.
3. ТРАНСКРИПЦИЯ ГЕНА.
57. Биосинтез РНК (транскрипция). Условия и этапы транскрипции. ТРАНСКРИПЦИЯ ГЕНА.
Транскрипция - передача информации с ДНК на РНК (биосинтез РНК). Транскрипции, в отличие от репарации, подвергаются только определённые части молекулы ДНК. Эта часть называется ТРАНСКРИПТОНОМ - фрагмент ДНК, транскрибируемый в РНК. ДНК эукариот прерывистая: участки, несущие информацию (ЭКЗОНЫ), чередуются с участками, не несущими информацию (ИНТРОНЫ). В ДНК с 5'-конца выделяют ПРОМОТОРНУЮ область - место присоединения РНК-ПОЛИМЕРАЗЫ. С 3'-конца - ТЕРМИНАТОРНАЯ зона. Эти области не транскрибируются.
УСЛОВИЯ ТРАНСКРИПЦИИ.
1. Матрица - 1 нить ДНК. Образуется транскрипционный глазок.
2. Структурные компоненты - РИБОНУКЛЕОЗИД-3-ФОСФАТЫ (АТФ, ГТФ, ЦТФ, УТФ). Они будут распадаться до МОНОФОСФАТОВ с выделением энергии.
3. ДНК-зависимая РНК-ПОЛИМЕРАЗА.
ОСНОВНЫЕ ЭТАПЫ ТРАНСКРИПЦИИ.
1. ИНИЦИАЦИЯ.
Заключается в присоединении РНК-ПОЛИМЕРАЗЫ к ПРОМОТОРУ, что приводит к расхождению нитей ДНК. Импульсом к присоединению РНК-ПОЛИМЕРАЗЫ является присоединение ТВР-белка к TATA-САЙТУ.
2. ЭЛОНГАЦИЯ (удлинение).
Соединение РИБОНУКЛЕОЗИДМОНОНУКЛЕОТИДОВ и образование фосфодиэфирных
связей между НУКЛЕОТИДАМИ с помощью РНК-ПОЛИМЕРАЗЫ, которая передвигается
вдоль нити ДНК. Присоединение НУКЛЕТИДОВ идет в соответствии с принципом
комплиментарности, только вместо ДЕЗОКСИНУКЛЕОТИДОВ будут РИБОНУКЛЕОТИДЫ, и вместо ТМФ - УМФ.синтез идёт со скоростью 30 - 50 НУКЛЕОТИДОВ в секунду, пока не дойдёт до Т-зоны.
3. ТЕРМИНАЦИЯ (окончание).Заключается в том, что со стороны 3'-конца образованной РНК присоединяется множество (до 200 - 300) АДЕНИЛОВЫХ НУКЛЕОТИДОВ - поли А. Образуется точная копия гена. АДЕНИЛОВЫЕ НУКЛЕОТИДЫ защищают 3'-конец от действия ЭКЗОНУКЛЕАЗ. С 5'-конца образуется защита, так называемый «САР» (чаще всего УДФ). Эта образовавшаяся копия гена называется ТРАНСКРИПТ.
4. ПРОЦЕССИНГ (созревание).
58. Процессинг РНК. Альтернативный сплайсинг. ПРОЦЕССИНГ (созревание).
Заключается в СПЛАЙСИНГЕ удаление неинформативных участков, и соединение ЭКЗОНОВ между собой. Играет важную роль в эволюции организмов, т.к. возможен альтернативный СПЛАЙСИНГ. Это свидетельствует о том, что из одной пре-ИРНК образуется несколько ИРНК и соответственно несколько белков, что проявляется в разнообразии признаков у организмов.
59. Биосинтез белка. Этапы трансляции и их хар-ка. Белковые факторы биосинтеза белка. Энергетическое обеспечение биосинтеза белка. Трансляция или собственно биосинтез белка - это перевод генетического текста М-РНК в последовательность аминокислот в белке. Характеристика белоксинтезирующего аппарата клетки.
1. МРНК - источник информации.
У эукариот имеется особенность - САР (шапка, кепка), представленная МЕТИЛ-ГТФ. САР защищает МРНК от гидролиза и способствует её соединению с РИБОСОМАМИ. С САР связываются САР-связывающие белки. На МРНК находится стартовый кодон, представленный триплетом АУГ, представленный аминокислотой - МЕТ.
РИБОСОМЫ - комплексы РРНК с порядка 80 белками, включая ферменты.
РИБОСОМА состоит из двух единиц- большой и малой. Она у ЭУКАРИОТ более крупная,
её формула 80S (40S и 60S). У ПРОКАРИОТ она имеет формулу 70S (30S и 50S)
Аминокислоты (20 видов).
ТРНК(31 вид).
Несоответствие числа транспортных РНК и числа кодонов (61) снимается за счёт возможности узнавания одной транспортной РНК нескольких кодонов данной аминокислоты (ГЛИЦИН имеет три варианта ДНК-кода - ГГУ, ГГЦ, ГГА). Все эти 3 варианта узнаются одним видом Т-РНК - ЦЦН. В состав транспортной РНК входят минорные азотистые основания, способные узнавать вариабельный участок разных кодонов одной и той же аминокислоты. Транспортная РНК выполняет функцию АДАПТОРА между МРНК и белком.
Фермент синтеза комплекса транспортной РНК с аминокислотой - АМИНОАЦИЛ-ТРНК-СИНТЕТАЗА (требует энергии АТФ).
Белковые факторы:
факторы ИНИЦИАЦИИ (ФИ) начала трансляции, факторы ЭЛОНГАЦИИ (ФЭ) - продолжатели, факторы ВЫСВОБОЖДЕНИЯ (R-факторы).
Ионы магния, как КОФАКТОРЫ.
АТФ, ГТФ - поддержка энергией.
Этапы трансляции:
1.РЕКОГНИЦИЯ (распознавание) - узнавание между аминокислотами и их транспортной
РНК.
2.АК + ТРНК аминоацил-т-РНК-синтетаза АК-ТРНК
 АТФ®АМФ + ФФ МЕТИОНИЛ-ТРНК
АТФ®АМФ + ФФ МЕТИОНИЛ-ТРНК
РЕКОГНИЦИЯ происходит столько раз, сколько аминокислот входит в состав белка.
3. ИНИЦИАЦИЯ - начало процесса трансляции.
На этом этапе РИБОСОМА взаимодействует с МРНК и находит стартовый кодон. Малая её единица взаимодействует с МЕТИОНИЛ-ТРНК и образует инициирующий комплекс, способный распознавать стартовый кодон. Этому предшествует разделение РИБОСОМЫ с помощью ФИ-3. Образование инициирующего комплекса происходит с помощью ФИ-2. Затем инициирующий комплекс присоединяется к МРНК с 5'-конца. Узнаванию 5'-конца способствуют САР и САР-связывающие белки. Реакцию обеспечивают ФИ-1. Сканирование инициирующим комплексом матричной РНК путём продвижения от 5' к 3'-концу до обнаружения стартового кодона антикодоном МЕТ-ТРНК. Данный процесс энергозависим, требует энергии АТФ. После обнаружения стартового кодона собирается полностью РИБОСОМА путём фиксации 60S единицы, и высвобождаются белковые ФИ-1,2,3 и САР-связывающие белки. В РИБОСОМЕ выделяют Р-участок и А-участок. Р-участок (ПЕПТИДИЛЬНЫЙ) - в нём происходит образование ПЕПТИДНЫХ связей. Это закрытая область РИБОСОМЫ. Вход в неё извне запрещён. А-участок (АМИНОАЦИЛЬНЫЙ). Это открытая область РИБОСОМЫ - для поступления следующей аминокислоты.
4. ЭЛОНГАЦИЯ (продолжение) протекает циклически в виде последовательной смены трёх
фаз:
- присоединение следующей АМИНОАЦИЛ-ТРНК в соответствии со смыслом следующего кодона. Для процесса требуется энергия ГТФ и ФЭ-1 (проникновение в РИБОСОМУ).
- ПЕПТИЗАЦИЯ. Фермент ПЕПТИДИЛТРАНСФЕРАЗА образует ПЕПТИДНУЮ связь между двумя аминокислотными остатками и одновременно разрушает сложноэфирную связь между первой аминокислотой и её ТРНК. В результате идёт образование растущего ПЕПТИДА в А-участке и высвобождение первой ТРНК.
- ТРАНСЛОКАЦИЯ (перемещение).
При этом происходит перемещение РИБОСОМЫ на один кодон в направлении 3'-конца. При этом все остальные компоненты (МРНК, ТРНК) остаются на месте. Для процесса требуется энергия ГТФ и белковый ФЭ-2. Процесс циклический, т.е. фазы чередуют друг друга. Это происходит до обнаружения стоп (нонсенс)-кодона. Он не кодирует ни одну аминокислоту. Элонгация становится невозможной. Элонгацию и инициацию обозначают как собственно трансляцию.
5. ТЕРМИНАЦИЯ (прекращение).
Стоп -кодон распознаётся R-факторами (РЕЛИЗИНГ). Эти факторы высвобождают из связи все компоненты белоксинтезирующего комплекса: РИБОСОМУ, МРНК, ПОЛИПЕПТИД. Помогает фермент - ПЕПТИДИЛТРАНСФЕРАЗА, отщепляющий транспортную РНК от образованного ПОЛИПЕПТИДА. Для ТЕРМИНАЦИИ нужна энергия ПГФ. РИБОСОМА может повторно использоваться в трансляции. Матричная РНК или повторно используется в трансляции, или гидролизуется. ПОЛИПЕПТИД вступает в этап ПРОЦЕССИНГА белка.
6. ПРОЦЕССИНГ белка (созревание) совокупность химических модификаций
ПОЛИПЕПТИДА, заканчивающихся формированием зрелой белковой молекулы. ПРОЦЕССИНГ белка может быть:
КОНТРАНСЛЯЦИОННЫЙ (во время трансляции)
ПОСТТРАНСЛЯЦИОННЫЙ.
Варианты ПРОЦЕССИНГА:
A) ограниченный протеолиз: отщепление N-концевой аминокислоты (МЕТ), отщепление ПЕПТИДНОГО фрагмента.
АЦИЛИРОВАНИЕ (присоединение остатка СНЗСООН)
ФОСФОРИЛИРОВАНИЕ
ГЛИКОЗИЛИРОВАНИЕ - образование ГЛИКОПРОТЕИНОВ и ПРОТЕОГЛИКАНОВ.
E) ГИДРОКСИЛИРОВАНИЕ аминокислот
F) ОКИСЛЕНИЕ аминокислот
G) Образование четвертичной структуры в случае ОЛИГОМЕРНОСТИ белка.
ПРОЦЕССИНГ включает в себя наивысшую точку - ФОЛДИНГ - сворачивание, обретение
белком высших уровней пространственно-структурной организации, заканчивающееся формированием структурно и функционально зрелой молекулы.
60. Строение оперона. Регуляция биосинтеза белка у прокариот. Функционирование лактозного и гистидинового оперонов. Несмотря на единство общего генотипа, в организме человека присутствует примерно 200 фенотипов клеток, и фенотипические различия определяются экспрессией генов. В каждой клетке, независимо от фенотипа, экспрессируются гены «домашнего хозяйства» обеспечивающие элементарные процессы жизнедеятельности, характерные для каждой клетки. Регуляция биосинтеза белка у ПРО- и ЭУКАРИОТ различна. У ПРОКАРИОТ основные положения теории регуляции изложены в 1961г. Ф. ЖАКОБОМ и Ж. МОНО.
1. Регуляция происходит только на уровне транскрипции. Первичные транскрипты генов у них
транслируются до завершения транскрипции.
2. Неоднородность ГЕНОМОВ. В геноме есть структурные гены и есть регуляторные области,
которые могут включать регуляторные элементы и регуляторные гены. Структурные гены
кодируют синтез структурных и функциональных белков. Регуляторные элементы не кодируют синтез белков вообще, но влияют на процесс транскрипции.
Регуляторными элементами являются:
- ПРОМОТОР - место прикрепления к ДНК РНК-ПОЛИМЕР АЗЫ, ОПЕРАТОР - место взаимодействия регуляторных белков с ДНК. Регуляторные гены кодируют синтез регуляторных белков. К ним относится белок -РЕПРЕССОР, который Может блокировать считывание информации, связываясь с оператором. Фрагмент ДНК, подверженный транскрипции называется ОПЕРОН (ПРОМОТОР, ОПЕРАТОР, структурный ген). За пределами ОПЕРОНА находятся гены-регуляторы, кодирующие синтез белка - РЕПРЕССОРА.
3. Регуляция биосинтеза белков у ПРОКАРИОТ протекает альтернативно путём репрессии и индукции.
ПРИМЕР: ЛАКТОЗНЫЙ ОПЕРОН. В микробной клетке лактоза с помощью лактазы расщепляется до галактозы и глюкозы. Лактозный ОПЕРОН регулирует синтез лактазы. Если в среде присутствует лактоза, то БЕЛОК-РЕПРЕССОР вытесняется из связи с оператором и гены лактазы транскрибируются. Лактоза выступает индуктором.
61. Особенности и уровни регуляции биосинтеза белка у эукариот. Амплификация генов, энхансерные и сайленсерные элементы. Регуляция биосинтеза белка у ЭУКАРИОТ происходит на всех уровнях матричных биосинтезов.
1. На уровне транскрипции - групповая репрессия гистонами. У человека 90% ДНК репрессировано.
2. Амплификация генов - повышение числа копий гена в геноме (повышается площадь транскрипции).
3. Регуляция транскрипции сигналами-регуляторами (усилителями и душителями). Для сигналов усилителей принят термин ЭНХАЙСЕР. Они не кодируют синтез белка, чрезвычайно эффективны, может наблюдаться 200-кратное усиление транскрипции. Действие не специфично (одновременно может влиять на группу генов). Значительно удалён от ПРОМОТОРА гена-мишени. Подвержен влиянию регуляторных факторов (гормонов). Сигналы-душители называются САЙЛЕНСЕРЫ - угнетатели транскрипции. Особенности действия подобны ЭНХАЙСЕРАМ, только действие противоположное.
4. Регуляция на уровне процессинга МРНК разрешение или запрещение процессинга
дифференциальный процессинг включает альтернативный СПЛАЙСИНГ - сборка РНК из разных экзонов, и редактирование МРНК - замена одного из нуклеотидов с изменением генетической информации, приводящее к образованию изменённых белков
5. На уровне стабильности и активности МРНК. МРНК в клетке образует комплекс с белками, который называется ИНФОРМОСОМА. В их составе МРНК не разрушается ферментами, сохранения в активном, стабильном состоянии. При необходимости она высвобождается из комплекса и транслируется. Процесс образования и распада ИНФОРМОСОМ регулируется гормонами. С одной молекулы РНК транслируется большое количество белков.
6. Регуляция на уровне трансляции:
Тотальная регуляция может быть в виде тотальной репрессии или индукции за счёт изменения концентрации белковых факторов трансляции. Избирательная дискриминация. Определённые виды МРНК избирательно не транслируются. С них не синтезируется белок. Трансляция с альтернативных стартовых участков. Т.о. образом может происходить выбор исходной стартовой точки трансляции.
62. Посттрансляционный процессинг. Фолдинг и адресование белков. Шапероны, прионы. ПРОЦЕССИНГ белка может быть:
КОНТРАНСЛЯЦИОННЫЙ (во время трансляции)
ПОСТТРАНСЛЯЦИОННЫЙ.
Варианты ПРОЦЕССИНГА:
A) ограниченный протеолиз: отщепление N-концевой аминокислоты (МЕТ), отщепление ПЕПТИДНОГО фрагмента.
АЦИЛИРОВАНИЕ (присоединение остатка СНЗСООН)
ФОСФОРИЛИРОВАНИЕ
ГЛИКОЗИЛИРОВАНИЕ - образование ГЛИКОПРОТЕИНОВ и ПРОТЕОГЛИКАНОВ.
E) ГИДРОКСИЛИРОВАНИЕ аминокислот
F) ОКИСЛЕНИЕ аминокислот
G) Образование четвертичной структуры в случае ОЛИГОМЕРНОСТИ белка.
ПРОЦЕССИНГ включает в себя наивысшую точку - ФОЛДИНГ - сворачивание, обретение
белком высших уровней пространственно-структурной организации, заканчивающееся
формированием структурно и функционально зрелой молекулы.
ШАПЕРОНЫ - над молекулярные комплексы белковой природы, способствующие быстрому и
правильному ФОЛДИНГУ. В большом числе представлены белками теплового шока.
ШАПЕРОНЫ препятствуют приобретению белком неправильной конформации. Неудачный ФОЛДИНГ заканчивается появлением аномальных белков, которые должны быть элиминированы.
УБИКВИТИН белок, присутствующий в каждой клетке организма. Это «билет» на уничтожение аномального белка. Белок, меченый УБИКВИТИНОМ, разрушается в ПРОТЕОСОМАХ. В норме обеспечивается гомеостаз структуры белка, сохранение его нативной структуры. При заболеваниях образуются аномальные белки, которые не утилизируются - ПРИОНЫ - ПРОТЕИНОГЕННЫЕ, информативные частицы. Это продукты неправильного ФОЛДИНГА, которые, попадая в организм извне, трансформируют нормальные белки данного организма в виде цепной реакции. ПРИОННЫЕ белки не расщепляются в ЖКТ, а всасываются в неизменённом виде. По сути ПРИОНЫ - это отрицательные ШАПЕРОНЫ. КОМПАРТМЕНТАЛИЗАЦИЯ БЕЛКОВ (механизмы адресования).
Белки должны быть правильно распределены в клетке или выделены из неё на экспорт. За этот процесс отвечает сигнальный участок - это фрагмент аминокислотной последовательности синтезированного ПОЛИПЕПТИДА, содержащего условный адрес размещения белка. Известно, что преобладание гидрофобных аминокислот в сигнальном участке, направляет белок в мембранную структуру клетки. Преобладание гидрофильных аминокислот в сигнальном участке способствует проникновению белка в цитоплазму и выделение на экспорт. Синтезированные белки могут быть в виде над молекулярных комплексов (ШАПЕРОНЫ, ПРОТЕОСОМЫ, белки мокро трубочек).
63. Виды молекулярных мутаций и их метаболические последствия. ВИДЫ ГЕННЫХ МУТАЦИЙ.
ДЕПУРИНИЗАЦИЯ - потеря или замена пуриновых оснований. За 70 лет теряется до 40%. С меньшей скоростью происходит ДЕЗАМИНИРОВАНИЕ и ДЕПИРИМИДИРОВАНИЕ. Белок Р-53 метит повреждённый участок ДНК. Если он работает, то включаются механизмы репарации. Если этого белка нет, то наступают мутации - нерепарированные изменения первичной структуры ДНК. Генные мутации затрагивают небольшой участок ДНК в пределах гена. Виды генных мутаций:
1. замена:
а) одного нуклеотида на другой без изменения смысла кода
ААГ® ААА (ЛИЗИН)
КВАЗИДУПЛЕТНОСТЬ - смысловую нагрузку несут в коде только два нуклеотида
б) замена одного нуклеотида на другой с изменением смысла кодона - МИССЕНС-МУТАЦИЯ
в) замена с образованием терминирующего кодона- НОНСЕНС-МУТАЦИЯ.
2. вставка:
а) вставка одного или нескольких кодонов без сдвига рамки считывания. В результате образуется белок, удлинённый на одну или несколько аминокислот.
б) вставка 1, 2 (но не кратного 3) нуклеотидов. Происходит сдвиг рамки считывания. В результате синтезируется белок со случайной аминокислотной последовательностью.
3. ДЕЛЕЦИЯ (выпадение):
а) выпадение одного или нескольких кодонов без сдвига рамки считывания. Образуется полипетид, укороченный на одну или несколько аминокислот.
б) выпадение одного или нескольких (но не кратное 3) нуклеотидов со сдвигом рамки считывания. Образуется ПОЛИПЕПТИД со случайной последовательностью аминокислот. По биологическим последствиям все мутации делятся на:
1. Нейтральные. В результате образуются белки с неизменёнными свойствами. Может произойти замена одной аминокислоты на другую, эквивалентную по свойствам (ВАЛ — АЛА, АСП — ГЛУ). Последствия не проявляются.
2. «Молчащие». В результате одна аминокислота заменяется на другую близкую по свойствам, но не эквивалентную. Свойства белка близки, но не совсем идентичные. Эта мутация в физиологических условиях может никак не проявиться, а в экстремальной ситуации может выявиться (обуславливает предрасположенность к заболеваниям)
3. Патогенные. Например, в гемоглобине А ГЛУТАМИНОВАЯ кислота даёт дополнительный отрицательный заряд, что способствует устойчивости белка в растворе. При замене её на ВАЛ устойчивость утрачивается и гемоглобин выпадает в осадок.
4. Полезные. Организм получает преимущества для выживания. Играют роль в эволюции организмов.
64. Биохимический полиморфизм. Генотипическая гетерогенность популяций. Наследственная непереносимость пищевых в-в и лекарств. Причины полиморфизма и динамичности белкового состава клеток (протеома) при определенной консервативности генома: роль особенностей транскрипции, трансляции, процессинга белка. В результате мутаций могут возникнуть варианты разных генов или одного и того же гена. Если они летальные, то наступает АПОПТОЗ. Если эти варианты не летальные, то они наследуются. Формируется генотипическая гетерогенность, следовательно, фенотипическая неоднородность.
Следствием генотипической гетерогенности является ПОЛИМОРФИЗМ белков -существование одного и того же белка в разных формах. Например, насчитывается около 700 вариантов гемоглобина. Каждый человек неповторим, биохимически уникален.
ПОСЛЕДСТВИЯ БИОХИМИЧЕСКОГО ПОЛИМОРФИЗМА.
1. Лежит в основе развития предрасположенности к заболеваниям (атеросклероз)
2. Лежит в основе непереносимости пищевых компонентов (лактозы)
3. Лежит в основе непереносимости лекарственных средств. ВЛИЯНИЕ АНТИБИОТИКОВ И ТОКСИНОВ НА БИОСИНТЕЗ БЕЛКА.
Антибиотики - продукты жизнедеятельности микроорганизмов, образуемые с целью гибели других микроорганизмов. Антибиотики поражают самые важные процессы - матричные биосинтезы.
1. Вызывают структурную модификацию матрицы.
2. Вызывают модификацию РИБОСОМ.
3. Инактивируют ферменты.
4. Действуют на процессы биосинтеза белка у микроорганизмов, обычно на этапе трансляции. СТРЕПТОМИЦИН нарушает инициацию трансляции. КИРРОМИЦИН препятствует высвобождению ФЭ трансляции. ЭРИТРОМИЦИН и ХЛОРАМФЕНИКОЛ ингибируют ПЕПТИДИЛТРАНСФЕРАЗУ.
Антибиотики на процессы трансляции у эукариот не влияют.
Токсины - вещества, действующие на процессы трансляции у эукариот.
Дифтерийный токсин ингибирует ФЭ и ТРАНСЛОКАЦИЮ. РИЦИН ингибирует большую единицу РИБОСОМ.
ОБРАТНАЯ ТРАНСКРИПЦИЯ. УОТСОН и КРИК считали, что информация может идти только в одном направлении: ДНК®РНК®белок.
В 1970г. американский учёный ТЕМЕН открыл ревертазу (ОБРАТНУЮ ТРАНСКРИПТАЗУ), обосновав возможность передачи информации в обратном направлении. Сейчас этот фермент называется РНК-зависимой ДНК-полимеразой. Он имеется у всех РНК содержащих вирусов (лейкоз мышей, ВИЧ).
Интеграция - внедрение вирусной ДНК в ДНК хозяина. При репликации последней образуется РНК вируса. Она покрывается оболочкой, выходит из клетки хозяина и начинает поражать другие клетки.
Многие вирусы являются ОНКОГЕННЫМИ. Они живут в ДНК человека. Онкогены несут информацию о белках опухолевого роста. Они определённое время неактивны -ПРОТООНКОГЕНЫ.
65. Понятие о протеомике. Критика принципа Бидла и Тейтума: 1 ген – 1 фермент. В 40-е годы 20в БИДЛОМ и ТЕЙТУМОМ выдвинут принцип: 1 ген - I фермент. Они исходили из общей схемы биосинтеза белка, однако этот принцип не объясняет:
1. Фенотипическое различие между клетками,
2. Индивидуальные различия между организмами одного вида. Каждый человек отличается от другого человека на 0,1% генома.
3. Широкое разнообразие белков. На основе 35000 генов синтезируются около 5000000 белков.
В настоящее время нельзя сказать точно, что изучать важнее - геном или белковый состав
организма.
ПРОТЕОМИКА - отрасль молекулярной биологии, изучающая структуру и функцию белков, взаимосвязь между ними.
ПРОТЕОМ - совокупность белков клетки или организма. В настоящее время можно составить протеомный портрет человека, существует ПРОТЕОМНАЯ ДАКТИЛОСКОПИЯ.
66. Блокаторы белковых синтезов. Действие антибиотиков и токсинов. Антибиотики - продукты жизнедеятельности микроорганизмов, образуемые с целью гибели других микроорганизмов. Антибиотики поражают самые важные процессы - матричные биосинтезы.
1. Вызывают структурную модификацию матрицы.
2. Вызывают модификацию РИБОСОМ.
3. Инактивируют ферменты.
4. Действуют на процессы биосинтеза белка у микроорганизмов, обычно на этапе трансляции. СТРЕПТОМИЦИН нарушает инициацию трансляции. КИРРОМИЦИН препятствует высвобождению ФЭ трансляции. ЭРИТРОМИЦИН и ХЛОРАМФЕНИКОЛ ингибируют ПЕПТИДИЛТРАНСФЕРАЗУ.
Антибиотики на процессы трансляции у эукариот не влияют.
Токсины - вещества, действующие на процессы трансляции у эукариот.
Дифтерийный токсин ингибирует ФЭ и ТРАНСЛОКАЦИЮ. РИЦИН ингибирует большую единицу РИБОСОМ.
67. Био роль теломер и теломераз. ТЕЛОМЕРЫ И ТЕЛОМЕРАЗЫ. ИХ РОЛЬ В РАЗВИТИИ ОПУХОЛЕВОГО РОСТА.
ТЕЛОМ ЕРЫ - это специализированные кольцевые районы хромосомной ДНК, состоящие из многократно повторяющихся НУКЛЕОТИДНЫХ последовательностей. При каждой репликации их количество уменьшается.
ТЕЛОМЕРАЗЫ - ферменты, синтезирующие теломеры. По свойствам представляют РНК -зависимую ДНК-полимеразу. В своей структуре содержат участок РНК, по которому синтезируется ДНК.
Количество теломер определяет длительность жизни. Если теломераза активна, то клетка бессмертна.
В 1960г. Л. ХЕЙФЛИК открыл феномен - лимит ХЕЙФЛИКА, который заключается в том, что клетка делится ограниченное количество раз, и оно зависит от возраста. У новорожденных клетка делится 80 - 90 раз, в 70лет 20 -30 раз. В среднем у взрослого человека клетки делятся 50 -60 раз. Это связано с эффектом «КОЦЕВОЙ НЕДОРЕПЛИКАЦИИ». Её существование предложил ОНОВНИКОВ.
При каждом раунде репликации одна нить ДНК укорачивается из-за удаления ПРАЙМЕРА. Если есть ТЕЛОМЕРЫ и ТЕЛОМЕРАЗА, то нить ДНК достраивается, если их нет, то с каждым моментом ДНК становится короче. Все соматические клетки содержат 10000-15000 пар нуклеотидов и отсутствует ТЕЛОМЕРАЗНАЯ активность. Клетки с теломеразной активностью бессмертны. Обнаружено, что в раковых клетках активируется теломераза и постоянно количество теломер. Макрофаги, лейкоциты, половые клетки, стволовые клетки костного мозга содержат теломеразную активность.
68. Хар-ка перспективной триады молекулярной биологии 21 века (геномика, протеомика, биоинформатика). ПРОТЕОМИКА - отрасль молекулярной биологии, изучающая структуру и функцию белков, взаимосвязь между ними.
ПРОТЕОМ - совокупность белков клетки или организма. В настоящее время можно составить протеомный портрет человека, существует ПРОТЕОМНАЯ ДАКТИЛОСКОПИЯ.
Развитие ГЕНОМИКИ и ПРОТЕОМИКИ невозможно без компьютерного обеспечения. Компьютеры помогают расшифровать геном, определять структуру белков, моделировать функции и признаки.
БИОДЕКОДОМИКА- раздел молекулярной биологии, занимающийся расшифровкой биологических тестов.
МЕТОДЫ И ПРИНЦИПЫ ГЕНОТЕРАПИИ.
ГЕНОТЕРАПИЯ - введение конструкции в организм человека с лечебной целью.
ГЕНОТЕРАПИЯ подразделяется на:
1. ГЕНОТЕРАПИЯ ex vivo, т.е. коррекция генов в клетках, выведенных за пределы организма, коррекция и возвращение клеток в организм. Появилась в 1986г. - впервые был вылечен иммунодефицит, что необходимо повторять 2 - 3 года, т.е. временные ограничения.
2. ГЕНОТЕРАПИЯ in vivo - системная генотерапия с заменой или введением вновь нормального гена во все клетки организма. Сложна и пока менее используется.
3. ГЕНОТЕРАПИЯ in situ - генетическую конструкцию вводят в зону патологического процесса. Например, блокаторы онкогенов вводят в место локализации опухоли после её удаления.
ГЕНОТЕРАПИЯ может быть фетальная (в настоящее время запрещена) и соматическая.
Способы доставки генов. Частицы, доставляющие фрагмент ДНК, называются векторами.
1. Вирусные - вирусные частицы, лишённые возможности вызывать заболевание, но сохраняют способность проникать в геном клетки и встраиваться в него. В них искусственно вводится нужный ген.
2. Невирусные:
белковые - белок как доставляющая частица;
наначастицы - мельчайшие капсулы, представленные фосфолипидами, содержащие в себе ген. Виды терапевтического переноса генов:
ИНТРО- или ЭКСТРОХРОМОСОМНАЯ КОРРЕКЦИЯ (за пределами хромосом),
Введение системы, продуцирующей нормальный белок взамен патологического - генно-
клеточная патология.
3. Блокада аномальных генов - обеспечивается комплиментарной последовательностью ДНК.
На 2001г. в мире было 3500 пациентов, получающих ГЕНОТЕРАПИЮ, более 2000 из них по
поводу раковых заболеваний. В мире утверждено 320 клинических протоколов ГЕНОТЕРАПИИ.
Перспективы: переход от генной к генно-клеточной терапии.
69. Основные углеводы организма человека, их строение и классификация, био роль. ОСНОВНЫЕ УГЛЕВОДЫ ЖИВОТНОГО ОРГАНИЗМА.
Углеводы - это ПОЛИОКСИКАРБОНИЛЬНЫЕ соединения и их производные.

Моносахариды: триозы (глицеральдегид, диоксиацетон), тетрозы (эритрулоза), пентозы (рибоза, дезоксирибоза, ксилулоза), гексозы (глюкоза, галактоза, фруктоза).
Олигосахариды (в состав молекулы входят 2-12 моносахаридов, соединённых между собой): мальтоза, лактоза, сахароза. Полисахариды делятся на гомополисахариды и гетерополисахариды. Гомополисахариды - крахмал, гликоген. Гетерополисахариды хонроэтинсерная к-та, гиалуроновая к-та, нейраминовая к-та, гепарин.
БИОЛОГИЧЕСКАЯ РОЛЬ УВ.
1. ЭНЕРГЕТИЧЕСКАЯ. При окислении 1 гр. УВ до конечных продуктов (СО2 и Н2О) выделяется 4,1-ккал-60-70 % всей калорийности пищи. Суточная потребность в УВ для взрослого человека с массой 60-70 кг составляет около 400-500 гр.
2. Структурная. УВ используется как строительный материал для образования структурных компонентов клеток (ГЛИКОЛИПИДЫ, ГЛИКОПРОТЕИНЫ, ГЕТЕРОПОЛИСАХАРИДЫ межклеточного вещества).
3.Резервная. УВ в виде гликогена могут откладываться в запас.
4. Защитная. ГЛИКОПРОТЕИНЫ принимают участие в образовании антител. ГИАЛУРОНОВАЯ К-ТА препятствует проникновению чужеродных веществ. ГЕТЕРОПОЛИСАХАРИДЫ участвуют в образовании слизи слизистых оболочек дыхательных путей, ЖКТ.
5. Регуляторная. Некоторые гормоны являются ГЛИКОПРОТЕИНАМИ (ТИРИОГЛОБУЛИН)
6.Участвуют в процессах распознавания клеток (СИАЛОВАЯ и НЕЙРОЛИНОВАЯ К-ТЫ).
7 Входя в состав оболочек эритроцитов, определяют группы крови.
8. Участвуют в процессах свёртывания крови, входя в состав ФИБРИНОГЕНА и ПРОТРОМБИНА. Препятствуют свёртыванию крови, входя в состав ГЕПАРИНА.
70. Роль углеводов в питании. Переваривание и всасывание еглеводов в органах пищеварит. системы. Написать р-ции. Непереносимость дисахаридов. ПРЕВРАЩЕНИЕ УГЛЕВОДОВ В ОРГАНАХ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ.
Основными УВ для организма человека являются УВ пищи: крахмал, сахароза, лактоза.
Поступивший с пищей крахмал в ротовой полости будет подвергаться гидролизу под действием альфа -АМИЛАЗЫ слюны. Она расщепляет альфа (1,4)-ГЛИКОЗИДНЫЕ связи. РН оптимум в слабощелочной среде (6,8). Поскольку пища в ротовой полости задерживается недолго, то крахмал здесь переваривается лишь частично. Гидролиз крахмала завершается образованием АМИЛОДЕКСТРИНОВ (с йодом дают фиолетовое окрашивание). Далее пища поступает в желудок. Слизистой оболочкой желудка ГЛИКОЗИДАЗЫ не вырабатываются. В желудке среда резко кислая, поэтому действие альфа -АМИЛАЗЫ прекращается. Однако в более глубоких слоях действие фермента продолжается (пищевой комок полностью желудочным соком не пропитывается), крахмал проходит следующую стадию гидролиза- ЭРИТРОДЕКСТРИНОВ (с йодом дают красное окрашивание). Основным местом переваривания крахмала служит тонкий отдел кишечника. Здесь наиболее важная фаза гидролиза крахмала. В 12 п.к. открываются протоки ПЖЖ. Под действием фермента в её секрете будет идти гидролиз крахмала. Выделяющийся панкреатический сок содержит БИКАРБОНАТЫ, которые нейтрализуют желудочное кислое содержимое. Образующийся при этом Н2СОЗ распадается. СО2 «вспенивает» пищевой комок, способствуя его перемешиванию. Создаётся слабощелочная среда. Катионы натрия и калия способствуют активации панкреатических ГЛИКОЗИДАЗ: альфа -АМИЛАЗЫ, АМИЛО-1,6-ГЛИКОЗИДАЗЫ, ОЛИГО-1,6-ГЛИКОЗИДАЗЫ. Эти ферменты завершают гидролитический разрыв внутренних ГЛИКОЗИДНЫХ связей. ЭРИТРОДЕКСТРИНЫ переходят в ОХРОДЕКСТРИНЫ (с йодом жёлтое окрашивание).
Альфа -АМИЛАЗА завершает разрыв внутренних альфа(1,4)-ГЛИКОЗИДНЫХ связей с образованием ДИСАХАРИДОВ (МАЛЬТОЗ). Альфа(1,6)-ГЛИКОЗИДНЫЕ связи в точках ветвления крахмала гидролитически расщепляются под действием АМИЛО-(1,6)-ГЛИКОЗИДАЗЫ и ОЛИГО-(1,6)-ГЛИКОЗИДАЗЫ, которая является терминальной в этом процессе. Т.о. 3 панкреатических фермента завершают гидролиз крахмала в кишечнике с образованием МАЛЬТОЗ. Образованная МАЛЬТОЗА - временный продукт гидролиза, т.к. она в клетках кишечника быстро гидролизуется под действием МАЛЬТАЗ. Из тех же остатков, которые в молекулах крахмала были соединены альфа(1,6)-ГЛИКОЗИДНЫМИ связями, образуются ДИСАХАРИДЫ -ИЗОМАЛЬТОЗЫ. Они будут гидролизоваться ИЗОМАЛЬТАЗАМИ. В составе пищи в организм человека поступают и ДИСАХАРИДЫ: лактозы и сахарозы, которые подвергаются гидролизу только в тонком кишечнике. В ЭНТЕРОЦИТАХ синтезируются ЛАКТАЗЫ и САХАРАЗЫ, которые осуществляют гидролиз с образованием глюкозы, галактозы, фруктозы.
Продукты полного гидролиза - МОНОСАХАРИДЫ - всасываются в кровь. На этом завершается начальный этап пищеварения. С пищей в организм человека поступает клетчатка, которая в ЖКТ не переваривается, поскольку отсутствуют бета -ГЛИКОЗИДАЗЫ. Однако биологическая роль клетчатки велика: 1.формирование пищевого комка,
2.она раздражает слизистую оболочку ЖКТ, усиливая секрецию желёз.
3.усиливает сокращение кишечника,
4. в толстом кишечнике под действием ферментов условно-патогенной микрофлоры клетчатка подвергается брожению с образованием глюкозы, лактозы и газообразных веществ.
71. Катаболизм глюкозы в анаэробных условиях. Гликолитическая оксидоредукция, ее субстраты. Био роль этого процесса. АНАЭРОБНЫЙ ГЛИКОЛИЗ протекает в цитоплазме клеток. Окисление глюкозы или глюкозного остатка гликогена всегда завершается образованием конечного продукта этого процесса- молочной кислоты.
Окисление глюкозы и глюкозного остатка гликогена в тканях отличается начальных стадиях превращения, до образования глюкозо-6-фосфата. Дальнейшее окисление с этого этапа в тканях как в АНА-, так и в АЭРОБНЫХ условиях полностью совпадает до стадии образования ПИРУВАТА.
Процесс АНАЭРОБНОГО ГЛИКОЛИЗА сложный и многоступенчатый. Условно его можно
разделить на 2 стадии:
-первая стадия заканчивается образованием из ГЕКСОЗЫ двух ТРИОЗ -ДИОКСИАЦЕТОНФОСФАТА и ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА.
-Вторая стадия наиболее важная. Её называют стадией ГЛИКОЛИТИЧЕСКОЙ ОКСИДОРЕДУКЦИИ. Она сопряжена с образованием АТФ за счёт реакций СУБСТРАТНОГО ФОСФОРИЛИРОВАНИЯ, окислением ГЛИЦРАЛЬДЕГИД -3-ФОСФАТА, восстановлением ПИРУВАТА до ЛАКТАТА.


Т.о. окислительный процесс в без кислородных условиях завершается образованием ЛАКТАТА. В процессе превращения глюкозы было израсходовано 2 молекулы АТФ (ГЕКСОКИНАЗНАЯ и ФОСФОФРУКТОКИНАЗНАЯ реакции). С этапа образования ТРИОЗ идёт одновременное их окисление. В результате этих реакций образуется энергия в виде АТФ за счёт реакций СУБСТРАТНОГО ФОСФОРИЛИРОВАНИЯ (ГЛИЦЕРАТКИНАЗНАЯ и ПИРУВАТКИНАЗНАЯ).
На этапе ГЛИКОЛИТИЧЕСКОЙ ОКСИДОРЕДУКЦИИ идёт окисление ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА в присутствии НЗРО4 и НАД- зависимой ДГ. которая на этом этапе восстанавливается до НАДН2.
72. Катаболизм гдюкозы в тканях в аэробных условиях. Гексозодифосфатных путь превращения глюкозы и его био роль.Эффект Пастера. МИТОХОНДРИИ в АНАЭРОБНЫХ условиях блокированы, поэтому НАДН2 находится в среде до тех пор, пока не образуется субстрат, способный принять его. ПВК, принимая НАДН2, восстанавливается с образованием ЛАКТАТА, завершая тем самым внутренний-окислительно-восстановительный этап ГЛИКОЛИЗА. НАД окисленный выделяется и может участвовать в окислительном процессе, выполняя роль переносчиков водорода.
Биологическая роль АНАЭРОБНОГО ГЛИКОЛИЗА энергетическая. АНАЭРОБНЫЙ ГЛИКОЛИЗ является единственным процессом продуцирующим энергию в форме АТФ в клетке в бес кислородных условиях в кризисных ситуациях. А в эритроцитах ГЛИКОЛИЗ является единственным процессом поддерживающим биоэнергетику, для сохранения их функции и целостности.
ГЕКСОЗОДИФОСФАТНЫЙ ПУТЬ - это аэробное превращение глюкозы в тканях. При поступлении кислорода в клетки происходит подавление анаэробного ГЛИКОЛИЗА. При этом понижается потребление глюкозы, блокируется образование ЛАКТАТА. Эффект торможения анаэробного гликолиза дыханием получил название эффекта ПАСТСРА. Процесс окисления начинается в цитоплазме до стадии образования ПИРУВАТА. Затем ПВК поступает в МИТОХОНДРИИ, где в матрице подвергается ОКИСЛИТЕЛЬНОМУ ДЕКАРБОКСИЛИРОВАНИЮ. Образующийся АЦЕТИЛ-КОА поступает для дальнейшего окисления в основной метаболический ЦТК КРЕБСА. С участием ферментов ЦТК и сопряженных с ним ферментов дыхательной цепи происходит образование конечных продуктов (СО2 иН2О) и выделяется 38 АТФ, а при окислении глюкозного остатка гликогена - 39 АТФ.
Энергетический эффект окисления глюкозы и глюкозного остатка гликогена в аэробных условиях:
АТФ = 2*(3+1 +1 +3+12) - 2 = 38 глюкоза
АТФ = 2*(3+1+ 1 +3+12) - 1 =39 гликоген
73. Гексозомонофосфатный путь превращения глюкозы в тканях и его био роль. Р-ции окислительной стадии образования пентоз. ГЕКСОЗОМОНОФОСФАТНЫЙ ПУТЬ (ПЕНТОЗНЫЙ, АПОТОМИЧЕСКИЙ) протекает в цитоплазме клетки и представлен 2 ветвями: окислительной и неокислительной. Особенно активно этот путь протекает в тех органах и тканях, в которых активно синтезируются жиры (печень, почки, жировая и эмбриональная ткань, молочные железы). Биологическая роль этого пути окисления глюкозы связывается прежде всего с производством двух веществ:
1.НАДФ*Н2, который в отличии от НАДН2 не используется вдыхательной цепи МИТОХОНДРИЙ, а поступает клетке для реакций синтеза и восстановления веществ.
2.РИБОЗО-5-ФОСФАТА и др. ПЕНТОЗ, которые используются в клетке для синтеза важнейших биологических молекул: ДНК, РНК, НТФ (АТФ, ГТФ, ЦТФ, ТТФ),Н5КОА, НАД, ФАД).
Следовательно, основная биологическая роль - АНАБОЛИЧЕСКАЯ. Неокислительная стадия ПЕНТОЗНОГО ПУТИ окисления глюкозы даёт субстраты, которые в анаэробных условиях поддерживают ГЛИКОЛИЗ (ФРУКТОЗО-6-ФОСФАТ, ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТ). Т.о. поддерживается биоэнергетика клетки в ГИПОКСИЧЕСКИХ ситуациях. Окислительная стадия представляет 5 реакций и предусматривает образование ПЕНТОЗ. ГЕКСОЗОМОНОФОСФАТНЫЙ путь отличается от ГЕКСОЗОДИФОСФАТНОГО пути с этапа превращения глюкозо-6-фосфата.
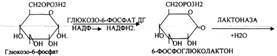
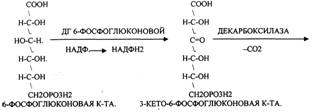

Не нашли, что искали? Воспользуйтесь поиском: