
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Структура нуклеиновых кислот
Структура ДНК
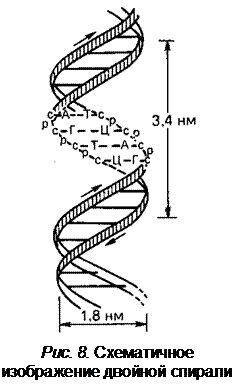 В 1953 г. Джеймс Уотсон и Фрэнсис Крик, основываясь на данных рентгеноструктурного анализа ДНК, пришли к выводу, что нативная ДНК состоит из двух полимерных цепей, образующих двойную спираль ДНК (рис. 8).
В 1953 г. Джеймс Уотсон и Фрэнсис Крик, основываясь на данных рентгеноструктурного анализа ДНК, пришли к выводу, что нативная ДНК состоит из двух полимерных цепей, образующих двойную спираль ДНК (рис. 8).
Навитые друг на друга полинуклеотидные цепи удерживаются водородными связями, образующимися между комплементарными основаниями противоположных цепей (аденин образует пару с тимином, а гуанин с цитозином). Стабильность А-Т пар обеспечивается двумя водородными связями, а пар Г-Ц – тремя. Длина водородных связей между основаниями составляет около 0,34 нм, расстояние между витками (шаг спирали) – 3,4 нм, на этом участке укладывается десять нуклеотидных пар, размер одного нуклеотида – 0,34 нм, диаметр биспиральной молекулы – 1,8 нм. Длина двуцепочечной ДНК обычно измеряется числом пар комплементраных нуклеотидов (п.н.). Для молекул ДНК, состоящих из тысяч или миллионов пар нуклеотидов, приняты единицы т.п.н. и м.п.н. соответственно.
Каждая линейная цепь имеет два конца, на одном из них расположена
5/ ОН – группа дезоксирибозы (не связанная с другим нуклеотидом), иногда она фосфорилирована. Это 5/-конец. На 3/-конце расположена свободная 3/ОН-группа.
Цепи молекул ДНК антипараллельны, одна имеет направление 3/ ® 5/ , другая 5/ ® 3/, что имеет важное биологическое значение при репликации и транскрипции молекул ДНК

Конфигурация двойной спирали может меняться в зависимости от количества содержания воды и ионной силы среды. В настоящее время существуют шесть форм (А-, В-, С-, Д-, Е-, Z-) (рис.9), каждая из которых имеет свои особенности.
Так, у А-формы наблюдается смещение пар оснований от оси молекул к периферии, длина одного витка – 2,8 нм, вместо десяти пар содержится одиннадцать. В Z-форме двойная спираль образует зигзагообразную линию вдоль спирали; встречается такая форма в условиях высокой ионной силы, в коротких синтетических ДНК.
Двойная спираль на некоторых участках может подвергаться дальнейшей спирализации с образованием суперспирали или открытой кольцевой формы. В некоторых вирусах обнаружены одноцепочечные ДНК линейной и кольцевой формы.
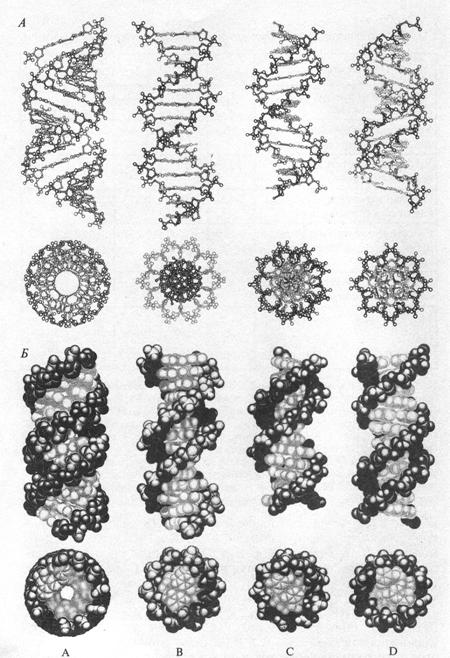
Рис. 9. А-, В-, С- и D-формы ДНК (вид сбоку и сверху)
А – скелетная модель, Б – объемная модель
Структура РНК
РНК – это линейная полинуклеотидная молекула, отличающаяся от ДНК рядом особенностей. Моносахаридом в РНК является рибоза, а вместо тимина содержится урацил. Соответственно? в РНК азотистые основания следующие: аденин (А), цитозин(С), гуанин (Г), урацил (У). Спаривание оснований происходит таким же образом, как и в ДНК, за исключением того, что вместо пары А-Т образуется А-У.
Гидроксильная группа во 2/-положении делает молекулу РНК химически более нестабильной по сравнению с ДНК. В разбавленном растворе щелочи РНК разрушается при комнатной температуре, а молекула ДНК устойчива.
Большинство молекул РНК одноцепочечные, хотя часто в них имеются взаимокомплементраные участки, образующие двуцепочечные структуры – «шпильки».
Существуют три основные типа РНК: информационная (матричная) – мРНК, рибосомная – рРНК, и транспортная – тРНК. Все они играют важную роль в процессе расшифровки генетической информации.
Роль мРНК заключается в переносе информации от ДНК в ядре до цитоплазмы, где она соединяется с рибосомами и служит матрицей, на которой осуществляется синтез белка.
мРНК разнообразны по молекулярной массе (от 0,05х106 до 4х106) и составляют около 2% от общего количества РНК в клетке. Каждую молекулу мРНК кодирует один ген или группа генов. В клетке постоянно образуется множество различных мРНК в соответствии с числом активных в данный момент генов. Время полужизни мРНК у эукариот от двадцати минут до нескольких часов, а у бактерий около двух минут.
Зрелая мРНК содержит 5/- и 3/-концевые нетранслируемые последовательности, длина которых варьирует у разных мРНК. На 5/-конце имеется «кэп»-структура (метилированный по 7/-положению гуанозин, связанный 5 /, 5/-трифосфатной связью со следующим основанием), на 3/- конце находится поли А-«хвост», содержащий от 20 до 250 нуклеотидов (рис. 10).

Рис. 10. Структура мРНК (А) и кэп-структура на 5/-конце мРНК эукариот (Б)
Считается, 5/-кэп и поли-А «хвост» защищают мРНК от быстрой деградации. 5/-кэп, кроме того, соединяясь со специфическим белком, принимает участие в связывании мРНК с рибосомами, способствует инициации синтеза белка, влияет на транспорт, трансляцию и распад мРНК. Считается, что не все мРНК содержат поли-А «хвост» (у мРНК гистонов их нет).
рРНК высокомолекулярны и составляют около 80% всех клеточных РНК. В клетках эукариот синтез РНК идет в ядрышке и осуществляется ферментом РНК-полимеразой I. Геном содержит от 50 до 1000 идентичных генов, кодирующих рРНК. Связываясь с определенными белками, рРНК организует важнейший аппарат клет-
ки – рибосомы, обеспечивающие синтез всех клеточных белков. На рРНК приходится около 60% массы рибосомы.
тРНК низкомолекулярны (мол.м. около 25000). На долю тРНК приходится 10-15% от общего количества тРНК. Основная функция тРНК – связывание соответствующих аминокислот и перенос их на рибосому с помощью фермента аминоацилсинтетазы. Для каждой аминокислоты существует специфическая аминоацилсинтетаза и тРНК. В настоящее время открыто около шестидесяти различных тРНК (для ряда аминокислот имеется более одной). Аминокислота присоединяется к свободной 3/ ОН-группе. Все тРНК обладают сходной структурой и напоминают клеверный лист (рис. 11).
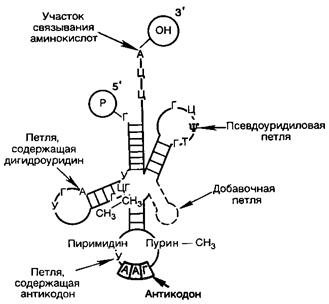
Рис. 11. Структура тРНК
Вопросы и задачи
1. Какие функции выполняют нуклеиновые кислоты?
2. Напишите структуру нуклеотида.
3. Назовите основные характеристики двойной спирали ДНК.
4. Какие связи обеспечивают формирование первичной и вторичной структуры нуклеиновых кислот?
5. Обьясните, что означает антипараллельность цепей ДНК в двойной спирали.
6. Назовите и охарактеризуйте виды РНК.
7. Установлено, что 22% общего числа нуклеотидов определенной мРНК приходится на гуанин, 35% - на цитозин, 19% – аденин и 24% - на урацил. Определите процентный состав азотистых оснований двуцепочечной ДНК, слепком с которой является эта мРНК.
Рекомендуемая литература
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия: Учебник. – М.: Медицина, 1998. – 704 с.
2. Биохимия. Краткий курс с упражнениями и задачами / Под ред. чл.-корр. РАН, проф. Е.С. Северина, проф. А.Я. Николаева. – М.: ГЭОТАР-МЕД, 2001.– 448 с.
3. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. – Пер. с англ. – М.: Мир, 2002. – 589 с.
4. Жимулев И.Ф. Общая и молекулярная генетика: Учебное пособие. – Новосибирск: Изд-во Новосиб. ун-та: Сиб. унив. изд-во, 2002. – 459 с.
5. Коничев А.С. Молекулярная биология: Учеб. для студ. пед. вузов / А.С. Коничев, Г.А. Севастьянова. – М.: Изд. центр «Академия», 2003. – 400 с.
6. Максимов Г.В., Степанов В.И., Василенко В.Л. Сборник задач по генетике: Учебное пособие. – М.: Вузовская книга, 2001. – 136 с.
7. Остерман Л.А. Методы исследования белков и нуклеиновых кислот. – М.: Наука, 1981. – 285 с.
8. Сельскохозяйственная биотехнология: Учебник / В.С. Шевелуха, Е.А. Калашникова, Е.С. Воронин и др. / Под ред. В.С. Шевелухи.– М.: Высшая школа, 2003. – 469 с.
9. Сингер М., Берг П. Гены и геномы: В 2 т. – Т. 1. – Пер. с англ. – М.: Мир, 1998. – 373с.
10. Степанов В.М. Молекулярная биология. Структура и функции белков.– М.: Высшая школа, 1996. – 335 с.
11. Уилсон Дж., Хант Т. Молекулярная биология клетки: Сб. задач. – Пер. с англ. – М.: Мир, 1994. – 520 с.
12. Эллиот В. Биохимия и молекулярная биология / В.Эллиот, Д. Эллиот; Под ред. А.И.Арчакова, М.П. Кирпичникова, А.Е. Медведева, В.П. Скулачева. – Пер. с англ. О.В. Добрыниной, И.С. Севериной, Е.Д. Скоцеляс и др. – М.:МАИК «Наука/ Интерпериодика», 2002. – 446 с.
ГЛАВА 3. ФЕРМЕНТЫ
Ферменты – вещества белковой природы, действующие как специфические высокоэффективные катализаторы химических реакций, протекающих в живых организмах. Они являются главным компонентом функционального аппарата клетки и обеспечивают осуществление таких важнейших процессов жизнедеятельности, как экспрессия наследственной информации, биоэнергетика, обмен веществ.
Наука о ферментах – энзимология зародилась в первой половине XIX века. В 1814 году петербургский ученый К.С. Кирхгоф установил, что крахмал превращается в сахар под действием факторов, находящихся в проросших зернах ячменя и экстрактах их солода. Это вещество было названо амилазой. В последующие годы были обнаружены и описаны другие факторы, обладающие каталитической активностью и действовавшие подобно дрожжам при брожении. Для обозначения этих факторов был предложен термин «фермент» (от лат. fermentatio - брожение). Термины фермент и энзим (от греч. en zyme - в дрожжах) являются синонимами.
По своей природе ферменты являются белками и при гидролизе распадаются на аминокислоты. Молекулярная масса их колеблется от 12 кД до 1000 кД. Ферменты, как и белки, обладают амфотерностью (могут существовать в растворе в виде катионов и анионов), электрофоретической подвижностью, осаждаются из водных растворов при низких температурах методами высаливания и т.д.
Энзимы – высокоэффективные катализаторы, способные увеличивать скорость реакций в 108-1020 раз.
По типу общей структурной организации выделяют несколько групп ферментов:
1. Ферменты, образованные одной полипептидной цепью (например, лизоцим).
2. Ферменты, образованные несколькими полипептидными цепями и соединенные дисульфидными мостиками (например, химотрипсин).
3. Олигомерные ферменты, образованные несколькими идентичными (например, фосфорилаза) или различными субъединицами (например, аспартаткарбамоилтрансфераза), связанные нековалентными связями.
4. Полифункциональные ферментные ансамбли, где одна полипептидная цепь образует активные центры нескольких функционально связанных ферментов (например, первые три фермента пути биосинтеза пиримидинов – карбамоилфосфатсинтетаза, аспартаткарбамоилтрансфераза и дигидрооротаза образованы одной полипептидной цепью с мол. м. 2150 кДа).
5. Полиферментные комплексы, состоящие из нескольких индивидуальных ферментов, которые, как правило, взаимосвязаны и катализируют серию последовательных реакций (например, пируватдегидрогеназный комплекс включает три фермента: пируватдегидрогеназный компонент, дигидролипоилтрансацетилазу и дигидролипоилдегидрогеназу).
Различают также ферменты простые и сложные. Простые ферменты представлены полипептидными цепями и при гидролизе распадаются на аминокислоты (пепсин, трипсин, лизоцим). Сложные ферменты для своей каталитической активности нуждаются в каком-либо небелковом компоненте – кофакторе. Кофакторы могут иметь различную химическую природу и различаются по прочности связи с полипептидной цепью. В качестве кофакторов могут выступать ионы металлов или сложные органические молекулы, последние называются коферментами. Некоторые ферменты содержат как кофермент, так и ионы металлов.
Если кофермент прочно связан с белком, то такой кофермент называют простетической группой. В других случаях кофермент образует с белком диссоциирующий комплекс, такой активный комплекс называется холоферментом, а белковая часть – апоферментом. Примерами таких комплексов являются пиродоксальфосфат, участвующий в различных превращениях аминокислот, никотинамидадениндинуклеотид – переносчик водорода.
К числу реакций, требующих присутствия коферментов, относятся окислительно-восстановительные реакции, реакции переноса групп и изомеризации, а также реакции конденсации (это классы 1, 2, 5, 6 по системе IUB, принятой Международным биохимическим союзом).
Большинство коферментов – производные витаминов, поэтому отсутствие их в пище человека и животных приводит к недостаточной активности некоторых ферментов и вызывает нарушение обмена веществ.
Коферменты подразделяются на следующие группы:
1. Коферменты, участвующие в переносе групп, кроме атомов водорода:
- сахарофосфаты,
- СоА·SH,
- тиаминпирофосфат,
- пиридоксальфосфат,
- фолианые коферменты,
- биотин,
- кобамидные коферменты (В12-коферменты),
- липоевая кислота.
2. Коферменты, участвующие в переносе атомов водорода или электронов:
- NAD+, NADP+,
- FMN, FAD,
- липоевая килота,
- кофермент Q.
Не нашли, что искали? Воспользуйтесь поиском: