
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ГЛАВА 3. ГОСУДАРСТВЕННАЯ СИСТЕМА КОНТРОЛЯ КАЧЕСТВА, ЭФФЕКТИВНОСТИ, БЕЗОПАСНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Для обеспечения безопасности и эффективности ЛС проходят государственный контроль, который осуществляется в соответствии с Федеральным законом «О лекарственных средствах» № 86-ФЗ.
ЛС относятся к видам продукции, несущим потенциальную опасность. Это объясняется тем, что некачественные или фальсифицированные лекарства могут принести вред здоровью. Согласно постановлению Правительства РФ от 29.04.2002 г. № 287 ЛС были отнесены к продукции, подлежащей обязательной сертификации.
С 1 января 2007 г. согласно постановлению Правительства РФ № 72 от 10.02.2004 г. по обязательной сертификации ЛС подтверждение их соответствия нормативным требованиям было изменено с сертификата соответствия на декларацию соответствия.
Процедура взаимодействия участников сертификации ЛС по существовавшей ранее (выдача сертификата соответствия) и новой (регистрация декларации соответствия) системе представлена на рис. 3.1.
Сертификацию ЛС производят органы (центры) по сертификации, аккредитованные в Системе сертификации ЛС на основании протоколов испытаний, выданных аккредитованными испытательными лабораториями. Обязательной сертификации подлежат ЛС:
- выпускаемые предприятиями-производителями ЛС на территории РФ;
- ввозимые на территорию РФ в порядке, установленном действующим законодательством.
При сертификации ЛС применяют схемы сертификации:
- испытание партии (серии) ЛС;
- сертификация производства или системы качества.
При сертификации ЛС изучают информацию о продукции, НД, регламентирующих показатели и методы испытаний; проводят идентификацию продукции, в том числе проверяют происхождение, соответствие продукции сопроводительной и НД, принадлежность к данной партии.
Сертификат действителен при поставке, продаже партии продукции в течение срока годности ЛС, установленного НД.
Сертификация импортируемых ЛС осуществляется по тем же правилам и схемам, что и сертификация отечественной продукции, на соответствие требованиям НД, утвержденным федеральным органом исполнительной власти в сфере здравоохранения.
При обязательной сертификации ЛС определены следующие участники процесса: заявители (производители или дистрибьюторы), орган по сертификации, испытательная лаборатория (см. рис. 3.1).
Информация о недоброкачественно произведенной или поставляемой продукции передается в органы федеральной исполнительной власти (Росздравнадзор). Недоброкачественная продукция подлежит уничтожению или, при ввозе из-за рубежа, - обратному экспорту производителю.
В период действия Системы сертификации ЛС возникала необходимость частичного сокращения объема испытаний ЛС в процессе их сертификации. Это в основном касалось предприятий, зарекомендовавших себя надежными поставщиками продукции стабильно высокого качества. Сокращение объема проводимых испытаний (контролируемых показателей НД) ЛС, выпускаемых отечественными предприятиями-производителями и зарубежными фирмамипроизводителями, которые не имели претензий к качеству выпускаемой продукции, допускалось по согласованию с Росздравнадзором.
Сокращенный объем испытаний (по числу нормативных показателей) проводили в отношении 70-80% всей продукции, обращаемой на фармацевтическом рынке.
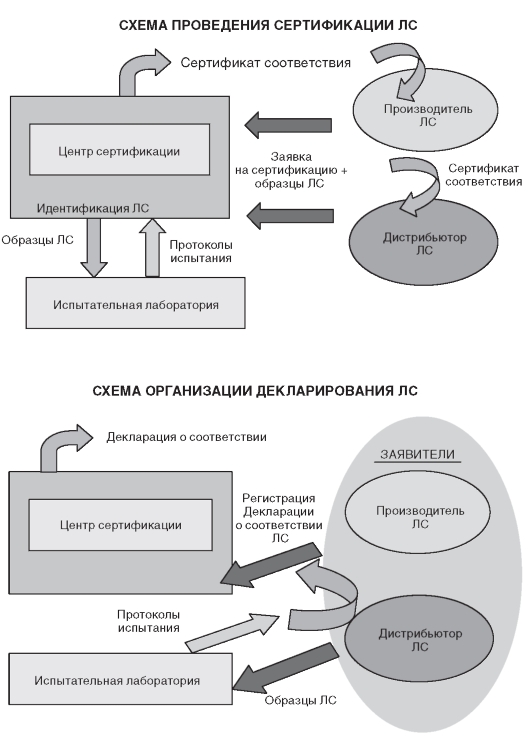
Рис. 3.1. Общая схема проведения сертификации лекарственных средств
(по: Елизарова Т.Е. Современные методы стандартизации и контроля качества лекарственных средств. - М.: МИА, 2008)
В отличие от процедуры обязательной сертификации с формой подтверждения сертификатом соответствия, при которой соответствие продукции и услуг подтверждалось третьей стороной - органом по сертификации, декларация о соответствии принимается исключительно первой стороной, т.е. производителем, продавцом. Декларация о соответствии, зарегистрированная в органе по сертификации, имеет такую же юридическую силу, что и сертификат соответствия.
Декларация соответствия широко используется в странах Европейского союза при подтверждении соответствия продукции Европейским директивам. Применяемый в ЕС при оценке соответствия модульный подход предусматривает обязательное принятие изготовителем декларации о соответствии независимо от того, использует ли изготовитель собственные доказательства или доказательства третьей стороны (уполномоченного органа). Таким образом, ответственность за качество и безопасность такой продукции возлагается исключительно на поставщика этой продукции.
Введенная с 1 января 2007 г. в РФ процедура декларирования соответствия для ЛС включает обязательное условие - подтверждение (доказательство) третьей стороной. В данном случае третьей стороной выступает аккредитованная в установленном порядке испытательная лаборатория (см. рис. 3.1).
Декларированию соответствия подлежат все ЛС, за исключением ЛС аптечного производства, ЛС, предназначенных для клинических испытаний или проведения регистрации в установленном порядке.
Обязательная сертификация ЛС за время ее существования в обеих формах подтверждения соответствия позволила значительно усилить контроль над обращением ЛС. Ее проведение до момента выпуска ЛС на рынок преградило путь многим недоброкачественным ЛС.
Контрольные вопросы и задания
• Как осуществляется государственный контроль, обеспечивающий безопасность и эффективность ЛС?
• Объясните необходимость прохождения процедуры декларирования соответствия качества ЛС.
• Поясните схему проведения декларирования качества ЛС.
• Объясните необходимость участия в процедуре декларирования соответствия для ЛС третьей стороны - испытательной лаборатории.
Не нашли, что искали? Воспользуйтесь поиском: