
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Испытания на чистоту. В природе соединения магния обычно встречаются одновременно с минералами щелочноземельных элементов - кальция
В природе соединения магния обычно встречаются одновременно с минералами щелочноземельных элементов - кальция, бария, а некоторые силикаты наряду с магнием содержат железо, поэтому в качестве примесей препараты магния могут содержать
кальций, барий, карбонаты щелочных металлов, железо, тяжелые металлы.
В зависимости от способа получения препаратов магния в них могут быть также примеси сульфатов и хлоридов. Содержание хлоридов не должно превышать 0,02%, а сульфатов - 0,05%. Если для обработки сырья использовали серную или соляную кислоту, загрязненную мышьяком, в препарате может присутствовать также примесь мышьяка (≤2х10-4%).
Допустимые пределы примесей: кальций (≤0,15%), растворимые карбонаты(≤1,25%), железо (≤0,03%), тяжелые металлы (≤5х10-4%), марганец (≤4х10-3%).
Иногда природные соединения магния бывают окрашены в зеленый цвет вследствие присутствия в них примеси соединений железа. Если исходное сырье для получения препаратов магния было плохо очищено от примесей железа, то и субстанция магния сульфата может быть слабо окрашена. Поэтому определяют прозрачность и цветность растворов магния сульфата.
В препаратах кальция хлорида не должны присутствовать примеси растворимых солей бария, железа, алюминия, фосфатов. Допустимым считают наличие примеси сульфатов, тяжелых металлов, мышьяка, солей магния, предельное содержание которых нормируется в ФС.
Фармакопея США содержит ФС «Кальция хлорид дигидрат». Если ЛС применяется при гемодиализе, то обязательны предварительные испытания на ионы алюминия (не более 1 мкг/г), которые могут легко концентрироваться в организме, вызывая отравления. При испытании на ионы железа, алюминия и фосфата к раствору (1 г в 20 мл воды) добавляют 2 капли 3 моль/л соляной кислоты и 1 каплю фенолфталеина, затем - аммиачный буфер, пока раствор не приобретет розовую окраску, и нагревают его до кипения. Не должно наблюдаться помутнения или образования осадка гидроксидов или фосфатов. Кроме того, контролируют примеси магния и щелочных металлов, а также летучие органические примеси.
Кальция хлорид для инъекций имеет рН от 5,5 до 7,5. Для ЛС обязателен контроль бактериальных эндотоксинов.
Количественное определение проводят комплексонометрическим методом, титрант - трилон Б. В качестве индикатора используется чаще всего кислотный хром черный специальный (эриохром черный Т). Его обычно применяют в кристаллическом виде.
При рН 8-10 индикатор взаимодействует с Mg2+ с образованием винно-красного комплекса Ind . Mg(II).
При титровании трилоном Б в точке эквивалентности цвет раствора переходит из красного в синий (цвет индикатора), так как протекает конкурирующая реакция образования более прочного координационного соединения иона магния с 6-дентатным лигандом - этилендиаминтетраацетат-ионом:
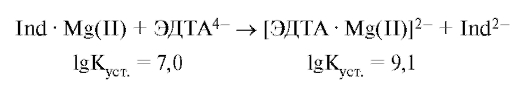
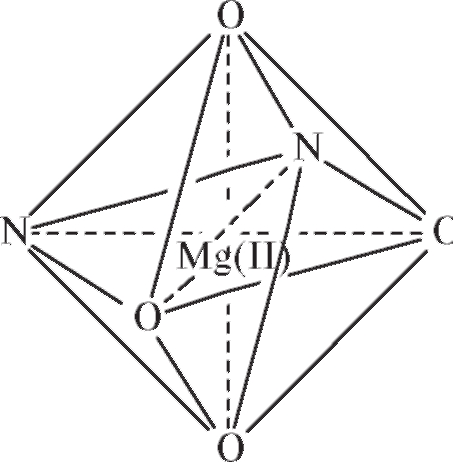
Прочность образующегося октаэдрического комплексного аниона [ЭДТА . Mg(II)]2- легко объяснима, если принять во внимание хелатную природу лиганда, образующего координационные связи иона металла с 2 донорными атомами азота и 4 атомами кислорода карбоксильных групп:
Содержание магния в препарате может быть определено весовым методом; при этом для осаждения используют как неорганические, так и органические реагенты. Можно применять двузамещенный фосфат натрия для осаждения магния в виде MgNH4PO4 с последующим прокаливанием осадка до пирофосфата магния MgP2O7. Из органических реактивов для весового определения магния чаще всего применяют 8-оксихинолин.
Количественное определение кальция хлорида в препарате проводят комплексонометрическим методом с индикатором «Кислотный хром темно-синий». Индикатор реагирует с Са2+ в щелочной среде с образованием вишнево-красного комплексного соединения. При титровании трилоном Б в точке эквивалентности окраска переходит в сине-сиреневую. Содержание кальция хлорида в препарате должно быть не менее 98,0%.
Кальция хлорид можно количественно определить аргентометрически по аниону:
CaCl2 + 2AgNO3 - 2AgCl↓ + Сa(NO3)2.
Фотометрические методы определения кальция основаны на применении специальных органических реактивов, дающих цветные комплексы с солями кальция.
Люминесцентные методы определения кальция предполагают использование соединений (например, флуорексон), которые с солями кальция в растворах образуют флуоресцирующие комплексы.
Контрольные вопросы и задания
• Какие соли катионов s- и d-элементов используют как ЛС?
• Почему запрещено применение в медицине и фармацевтическом анализе соединений ртути?
• Какая соль магния называется «горькая/английская соль»? Каково ее терапевтическое применение?
• Какие ЛС, содержащие ион кальция, применяют в медицине?
• Известно, что ион бария обладает токсическим действием. Используют ли соли бария в качестве фармацевтических препаратов?
• Охарактеризуйте физические и химические свойства магния сульфата и кальция хлорида. В какой химической форме присутствует магний и кальций в жидких средах организма?
• Какова физиологическая роль ионов Ca2+ и Mg2+ в организме?
• Приведите примеры реакций определения подлинности препаратов магния и кальция. Каковы условия их проведения?
• Принимая во внимание то, что в организме ионы кальция и магния - антагонисты, перечислите катионы металлов, являющиеся недопустимыми примесями в препаратах магния сульфат и кальция хлорид. • Опишите суть методов количественного (комплексонометрического) определения магния сульфата и кальция хлорида в фармацевтических препаратах и субстанциях. Приведите уравнения химических реакций и расчетные формулы.
Не нашли, что искали? Воспользуйтесь поиском: