
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Завдання 3. Одержання водню з розчину лугу
Покладіть у пробірку кілька кусочків алюмінієвих ошурок, додайте розчину NаОН, закріпіть пробірку в затискачі штатива, закрийте її корком з відтягнутою трубкою і спостерігайте перебіг реакції. Спочатку реакція відбувається повільно, а потім досить бурхливо. Доведіть, що в результаті реакції виділяється водень. Напишіть рівняння реакції.
Завдання 4. Відновні властивості водню в момент виділення
Налийте в дві пробірки по 1-2 см  розведеної сульфатної кислоти і долийте декілька крапель розчину калію перманганату. Додайте в одну з пробірок кусочок цинку, а в другу - пропустіть водень, зануривши кінець газовідвідної трубки в розчин. Зверніть увагу на те, що обезбарвлення розчинів в обох пробірках відбувається з різною швидкістю. Напишіть рівняння реакції, знаючи, що манган відновлються до двовалентного.
розведеної сульфатної кислоти і долийте декілька крапель розчину калію перманганату. Додайте в одну з пробірок кусочок цинку, а в другу - пропустіть водень, зануривши кінець газовідвідної трубки в розчин. Зверніть увагу на те, що обезбарвлення розчинів в обох пробірках відбувається з різною швидкістю. Напишіть рівняння реакції, знаючи, що манган відновлються до двовалентного.
Завдання 5. Вивчення взаємодії лужних та лужноземельних
металів з водою
У три пробірки налийте 1-2 см  води і помістіть кусочки очищених: а)металічного натрію; б)металічного магнію; в)металічного кальцію. Спостерігайте виділення газу. Ті пробірки, де реакція протікає недостатньо інтенсивно, підігрійте. Після закінчення реакції реакційну суміш охолодіть і добавте декілька крапель фенолфталеїну. Що ви спостерігаєте? Напишіть рівняння реакції. Визначіть оксидник і відновник
води і помістіть кусочки очищених: а)металічного натрію; б)металічного магнію; в)металічного кальцію. Спостерігайте виділення газу. Ті пробірки, де реакція протікає недостатньо інтенсивно, підігрійте. Після закінчення реакції реакційну суміш охолодіть і добавте декілька крапель фенолфталеїну. Що ви спостерігаєте? Напишіть рівняння реакції. Визначіть оксидник і відновник
Завдання 6. Забарвлення полум'я йонами лужних та
лужноземельних металів
Внесіть дротинку з нержавіючої сталі з петлею на кінці в полум'я пальника і прожарте її до припинення забарвлення полум'я. Охолоджену дротинку змочіть у розчині відповідної солі або занурте в кристали цієї солі і внесіть у полум'я пальника. Відмітьте колір полум'я і занесіть його в таблицю. Дротинку прожарюйте, доки забарвлення не зникне, після чого проведіть дослід з наступною сіллю.
Таблиця
Колір полум'я, викликаний йонами лужних та лужноземельних металів.
| Йони лужних металів | Йони лужноземельних металів | ||
| Йон | Колір полум’я | Йон | Колір полум’я |
| Li+ | 
| ||

| 
| ||

| 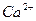
| ||

| 
| ||

| 
|
Зробіть відповідні висновки.
Завдання 7. Утворення та усунення карбонатної твердості води
У пробірку до половини її об'єму налийте вапняної води і опустіть в неї газовідвідну трубку від апарата Кіппа, зарядженого мармуром і хлоридною кислотою. Пропускайте в розчин несильний струмінь газу і слідкуйте, щоб розчин не викидало цим струменем із пробірки. Відмітьте появу осаду кальцію карбонату. Продовжуйте пропускати СО2 до повного розчинення осаду, який супроводжується утворенням кальцію гідрокарбонату Са(НСО3)2. Напишіть рівняння реакції. Як називається вода, що містить кальцію гідрокарбонат?
Отриманий розчин розділіть на дві пробірки:
· Половину отриманого розчину обережно нагрійте до кипіння і утворення осаду кальцію карбонату. Напишіть рівняння реакції розкладу Са(НСО3)2 при кип'ятінні.
· До другої половини розчину добавте декілька крапель розчину NаОН до утворення осаду СаСO3. Напишіть рівняння реакції.
ЛІТЕРАТУРА
1.Державна Фармакопея України / Держ. підприємство “Науково-експертний фармакопейний центр.” –1-е вид. –Харків: РІРЕГ, 2001. –556 с.
2.Коровин Н.В. Общая химия. –М.: Высшая школа, 1998. –559 с.
3.Угай Я.А. Общая и неорганическая химия. –М.: Высшая школа, 1997. –527 с.
4.Конспект лекцій.
5.Практикум з загальної та неорганічної хімії: Посібник // Є.Я.Левітін, Р.Г.Клюєва, А.М.Бризицька та ін. –Х.: Основа, 1998. –119 с.
6.Неорганическая химия.: Учебное пособие для студ. фармац. спец. вузов (Практикум) // А.К.Сухомлинов, Н.В.Боровская, П.Я.Пустовар и др. –Киев: Высшая школа, 1983. –167 с.
7.Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. К.: Вища школа, 1991. –430 с.
8.Романова Н.В. Загальна та неорганічна хімія. К.: Вища школа, 1998. –480 с.
9.Ахметов Н.С. Общая и неорганическая химия.: Учебное пособие для студ. хим.-техн.спец. вузов. –М.: Высшая школа, 1998. –743 с.
10.Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. –М.: Высшая школа, 1993. –592 с.
11.Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи загальної хімії / За ред. В.С.Телегуса: Підручник. –Львів: Світ, 2000. –424 с.
12.Скопенко В.В., Григор’єва В.В. Найважливіші класи неорганічних сполук. К.: Либідь, 1996. –151 с.
13.Вступ до хімічної номенклатури / О.А.Голуб, М.Ю.Корнілов, В.В.Скопенко та ін. К.: Школяр, 1997. –48 с.
14.Корнілов М.Ю., Білодід О.І., Голуб О.А. Термінологічний посібник з хімії. –К.: ІЗМН, 1996. –256 с.
15.Зайцев О.С. Общая химия. Состояние веществ и химические реакции. М.: Химия, 1990. –352 с.
ЗАНЯТТЯ №40
ТЕМА: Підсумковий контроль модуля 2 «Неорганічна хімія».
АКТУАЛЬНІСТЬ: дана робота необхідна студентам для знання властивостей елементів головних та побічних підгруп періодичної системи Д.І.Менделєєва, для закріплення і засвоєння знань з пройдених тем.
НАВЧАЛЬНІ ЦІЛІ: З’ясувати значення елементів та сполук елементів головних та побічних підгруп періодичної системи Д.І.Менделєєва в медичній та фармацевтичній практиці. Перевірка засвоєння студентами знань із раніше вивчених тем.
ЗНАТИ: -фізичні та хімічні властивості елементів головних та побічних
підгруп періодичної системи Д.І.Менделєєва;
-характерні ступені оксидації елементів головних та побічних підгруп
періодичної системи Д.І.Менделєєва;
-значення сполук елементів головних та побічних підгруп
періодичної системи Д.І.Менделєєва для медицини і фармації.
ВМІТИ: -записати характерні хімічні реакції елементів та сполук елементів
головних та побічних підгруп періодичної системи Д.І.Менделєєва;
-розв'язувати типові розрахункові задачі;
-застосовувати знання з пройдених тем на практиці.
САМОСТІЙНА ПОЗААУДИТОРНА РОБОТА
1.Загальні закономірності зміни кислотно-основних та оксидаційно-відновних властивостей d-елементів при переході від нижчих до вищих ступенів оксидації.
2.Залежність оксидаційно-відновних властивостей сполук d-елементів від рН середовища (на прикладі Хрому та Мангану).
3.Загальна характеристика Молібдену і Вольфраму, здатність до утворення ізополі- та гетерополікислот.
4.Загальна характеристика елементів підгрупи Арсену. Бінарні сполуки з воднем, киснем, сіркою та іншими неметалами, їх одержання та кислотно-основні властивості.
5.Манган, положення в періодичній системі Д.І.Менделєєва. Характерні ступені оксидації. Природні сполуки.
6.Здатність d-елементів до комплексоутворення. Катіонні, аніонні та нейтральні комплекси. Хімічний зв’язок в комплексних сполуках.
7.Галогеніди металів. Їх застосування в фармації.
8.Роль металів в фізіологічних процесах, що відбуваються в живих організмах.
9.У якій масі води треба розчинити 5 г мідного купоросу CuSO4•5H2O, щоб 1 г приготовленого розчину містив 0,04 г безводної солі?
10.Визначте молярну масу еквівалента мангану в реакції з киснем, якщо утворюється: а) MnO2; б) Mn3O4.
11.Під час прожарювання 1 г оксиду металічного елемента в струмені водню виділилося 0,284 г води. Визначте молярні маси еквівалентів елемента та його оксиду.
12.Які координаційні числа характерні для Мангану, Технецію та Ренію в їхніх сполуках?
13.Напишіть рівняння реакцій, що можуть відбуватися між калію хроматом та: а) хлоридною кислотою; б) сульфатною кислотою. Вкажіть умови, за яких дані реакції є можливими.
14.Кислотно-основні властивості сполук Цинку.
15.Сульфіди арсену, їх характер, розчинення в лугах та сульфіді амонію.
16.Фізико-хімічні основи застосування сполук елементів побічних підгруп та підгрупи Арсену в фармації.
17.Хімічні властивості Арсену. Взаємодія з нітратною кислотою.
18.”Царська вода”, взаємодія з золотом і платиною.
19.Хрому гідроксид та надхромові кислоти.
20.Солі Феруму. Ферити і ферати, їх добування і застосування.
21.Оксигеновмісні сполуки Хрому, добування і характер оксидів та гідратних форм.
22.Хімічні властивості Кобальту та Ніколу.
23.Тіосолі Арсену та Стибію, їх одержання і властивості.
24.Валентні особливості d-елементів. Потенціали йонізації, спорідненність до електрону, відносна електронегативність, електродні потенціали, ряд напруг.
КОНТРОЛЬНІ ПИТАННЯ
1.Електронна структура атомів елементів побічних підгруп та підгрупи Арсену в нормальному та збудженому стані.
2.Хімічні властивості Мангану.
3.Оксигеновмісні сполуки Мангану. Характер оксидів та їх гідратних форм. Оксидаційно-відновні властивості.
4.Загальна характеристика d-елементів VI групи. Природні сполуки та методи добування.
5.Хімічні властивості Хрому та його сполук.
6.Кислотно-основна та оксидаційно-відновна характеристика сполук Феруму (II) та Феруму (III).
7.Комплексні сполуки Феруму з ціанід-, роданід-йонами, диметилгліоксимом, оксидом карбону (II), гемоглобіном.
8.Найважливіші сполуки Кобальту та Ніколу, здатність до комплексоутворення. Реакція Чугайова.
9.Найважливіші сполуки міді, срібла та золота, їх кислотно-основна та оксидаційно-відновна характеристика, здатність до комплексоутворення.
10.Особливості фізичних і хімічних властивостей ртуті та її сполук.
11.Хімізм токсичної дії сполук кадмію та меркурію.
12.Комплексна природа цинквмісних ферментів та хімізм їх дії.
13.Комплексні сполуки Цинку, їх застосування.
14.Хромати та дихромати. Їх оксидаційні властивості. Рівновага в розчині хромат- і дихромат-йонів.
15.Якісні реакції на катіони Fe2+ і Fe3+.
16.Арсенітна, арсенатна кислота і їх солі. Кислотні та оксидаційно-відновні властивості.
17.Солі Стибію та Бісмуту, їх гідроліз.
18.Арсин, його одержання і властивості. Застосування в хіміко-токсикологічних дослідженнях.
19.Хімічні властивості стибію та бісмуту. Оксиди Стибію, їх характер і відповідні кислоти. Сполуки Стибію з галогенами та сіркою. Характерні сполуки Бісмуту, їх властивості.
20.Найважливіші неорганічні препарати елементів побічних підгруп та підгрупи Арсену, які використовуються в медицині і фармації.
21.Чому від Феруму до Нікелю стійкість сполук із ступенем оксидації +3 зменшується, а їз ступенем оксидації +2 – збільшується?
22.На гідроксиди цинку та кадмію подіяли надлишком розчину сульфатної кислоти, лугу, аміаку. Які сполуки при цьому утворилися? Напишіть рівняння відповідних реакцій.
23.Які хімічні реакції використовують для видалення залишків металічної ртуті, що вилилася внаслідок необережного поводження з нею?
24.Охарактеризуйте розчинність сульфідів Цинку, Кадмію та Гідраргіуму в кислотах. Чи можна використати різне відношення сполук до кислот для розділення суміші порошків ZnS, CdS та HgS? Якщо так, то яким чином здійснити таке розділення?
САМОСТІЙНА РОБОТА НА ЗАНЯТТІ
Відповідати на питання викладача, які будуть задаватися студентам з теми "Підсумковий контроль модуля 2 «Неорганічна хімія». Розв'язування типових задач. Письмова робота.
ЛІТЕРАТУРА
1.Державна Фармакопея України / Держ. підприємство “Науково-експертний фармакопейний центр.” –1-е вид. –Харків: РІРЕГ, 2001. –556 с.
2.Коровин Н.В. Общая химия. –М.: Высшая школа, 1998. –559 с.
3.Угай Я.А. Общая и неорганическая химия. –М.: Высшая школа, 1997. –527 с.
4.Конспект лекцій.
5.Практикум з загальної та неорганічної хімії: Посібник // Є.Я.Левітін, Р.Г.Клюєва, А.М.Бризицька та ін. –Х.: Основа, 1998. –119 с.
6.Неорганическая химия.: Учебное пособие для студ. фармац. спец. вузов (Практикум) // А.К.Сухомлинов, Н.В.Боровская, П.Я.Пустовар и др. –Киев: Высшая школа, 1983. –167 с.
7.Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. К.: Вища школа, 1991. –430 с.
8.Романова Н.В. Загальна та неорганічна хімія. К.: Вища школа, 1998. –480 с.
9.Ахметов Н.С. Общая и неорганическая химия.: Учебное пособие для студ. хим.-техн.спец. вузов. –М.: Высшая школа, 1998. –743 с.
10.Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. –М.: Высшая школа, 1993. –592 с.
11.Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи загальної хімії / За ред. В.С.Телегуса: Підручник. –Львів: Світ, 2000. –424 с.
12.Скопенко В.В., Григор’єва В.В. Найважливіші класи неорганічних сполук. К.: Либідь, 1996. –151 с.
13.Вступ до хімічної номенклатури / О.А.Голуб, М.Ю.Корнілов, В.В.Скопенко та ін. К.: Школяр, 1997. –48 с.
14.Корнілов М.Ю., Білодід О.І., Голуб О.А. Термінологічний посібник з хімії. –К.: ІЗМН, 1996. –256 с.
15.Зайцев О.С. Общая химия. Состояние веществ и химические реакции. М.: Химия, 1990. –352 с.
16.Яцимирський К.Б., Яцимирський В.К. Хімічний зв’язок. К.: Вища школа, 1993. –309 с.
17.Фримантл М. Химия в действии: В 2-х ч. / Пер. с англ. –М.: Мир, 1991. –Ч.1.-528 с.; Ч.2. –622 с.
18.Загальна та неорганічна хімія: Підруч. для студ. вищ. навч. закл. (Ч.2) // О.М.Степаненко, Л.Г.Рейтер, В.М.Ледовських, С.В.Іванов. –К.: Пед. Преса, 2000. -784 с.
19.Оганесян Э.Т. Неорганическая химия для фармацевтических вузов. –М.: Высшая школа, 1983. –523 с.
20.Перепелиця О.П. Властивості та екологічний вплив хімічних елементів: Довідник. –К.: Вентурі, 1997. –192 с.
ЗАНЯТТЯ №42
ТЕМА: Хімія елементів ІІБ підгрупи (Цинк, Кадмій, Меркурій).
Не нашли, что искали? Воспользуйтесь поиском: