
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Законы газового состояния
Закон объемных отношений (Гей–Люссака): при неизменных температуре и давлении объемы вступающих в реакцию газов относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
Закон Авогадро: в равных объемах любых газов при одинаковых условиях (Т, р) содержится равное количество молекул.
Следствия из закона Авогадро:
1.При одинаковых условиях 1 моль любого газа занимает одинаковый объем.
2.При н.у. 1 моль различных газов занимает объем 22,4 л (молярный объем газа, л/моль).
3.Отношение масс равных объемов различных газов равно отношению их молекулярных масс:

где m1 и m2 – массы, а 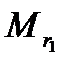 и
и  – молекулярные массы первого и второго газов.
– молекулярные массы первого и второго газов.
 - относительная плотность первого газа по второму.
- относительная плотность первого газа по второму.
Тогда 
Объединенный газовый закон:

где р0, V0, Т0 – соответственно давление, объем, температура при н.у. (р0 = 101325 Па, Т0 = 0 ºС (273 К); р, V, Т – те же параметры данного количества газообразного вещества при других условиях).
Для 1 моль любого газа при н.у.:

R - универсальная газовая постоянная, R = 8,314 Дж/(моль×К)
Для 1 моля газа тогда имеем:

Это уравнение состояния идеального газа.
Если количество газа другое, то получим уравнение Менделеева – Клапейрона:
 (n – число молей данного вещества).
(n – число молей данного вещества).
Закон парциальных давлений: общее давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь:

где р – общее давление; р1, р2 … - парциальные давления газов 1, 2 …
Парциальное давление газа в смеси – давление, которое производило бы это же количество данного газа, если бы он один занимал при этой же температуре весь объем, занимаемый смесью.
Не нашли, что искали? Воспользуйтесь поиском: