
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Гальванический элемент
Гальванический элемент – это устройство, в котором на основе ОВР получают электрический ток. Наиболее простой медно-цинковый или элемент Даниэля-Якоби. Ячейка, для измерения электродных потенциалов – гальванический элемент – устройство в котором химическая энергия ОВР преобразуется в электрический ток.
Процесс окисления (отдача электронов) на аноде (отрицательный полюс), процесс восстановления (присоединения) электронов – на катоде (положительный полюс)
Причина возникновения электрического тока – разность электродных потенциалов (ЭДС).
ЭДС = Ек - Еа > 0, то Ек > Еа, т.е. катод – электрод с более высоким электродным потенциалом.
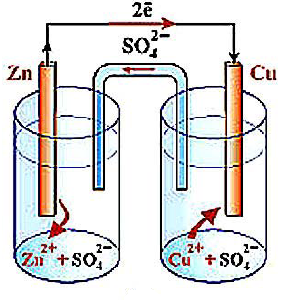
Рис. 1.8.1. Гальванический элемент Даниэля-Якоби
Пластины цинка и меди опущены в раствор солей (сульфатов цинка и сульфата меди (II)). На электроде из цинка происходит окисление атомов цинка в ионы (растворение):
Zn - 2e = Zn+2 (анод)
Электроны поступают во внешнюю цепь. На медном электроде – восстановление ионов Cu2+ в атомы, которые осаждаются на электроде:
Cu2++2е = Cu0 (катод)
Электрод на котором протекает процесс окисления – анод, восстановление – катод.
Суммарное уравнение:
Zn-2e= Zn+2 (анодный процесс)
Cu2++2е=Cu0 (катодный процесс)
Zn+ Cu2+= Zn+2+ Cu0
или в молекулярной форме
Zn+CuSO4 = ZnSO4+Cu
Цинковый электрод - источник электронов – отрицательный, медный – положительный. В результате возникновения разности потенциалов протекает электрический ток.
ЭДС гальванического элемента можно вычислить по разности стандартных электродных потенциалов. Т.к. ЭДС должно быть >0, поэтому надо из потенциала электрода имеющего большую алгебраическую величину, вычитать электрод, алгебраическая величина которого меньше.
∆Е (ЭДС) = ЕК - ЕА
В таблице стандартных электродных потенциалов
Е0Zn+2/Zn= - 0,763 В, Е0Cu2+/Cu = +0,337 В
Тогда ЭДС = Е0Cu2+/Cu - Е0Zn+2/Zn = 0,337 - (-0,763) = 1,1В
Электроны будут переходить от металла с более отрицательным потенциалом к металлу с более положительным. Схема работы данного гальванического элемента: А(-) Zn0/Zn 2+// Cu2+/Cu0 К(+).
Электролиз
Электролиз – это совокупность процессов, проходящих на электродах при прохождении электрического тока через раствор или расплав электролита. Электролиты – проводники второго рода. При электролизе катод служит восстановителем (отдает электроны катионам), а анод – окислителем (принимает электроны от анионов). Сущность электролиза состоит в осуществлении за счет электрической энергии химических реакций – восстановления на катоде (К) и окисления на аноде (А). Эти процессы называются процессами (реакциями) электровосстановления и электроокисления. Восстановительное и окислительное действие электрического тока во много раз сильнее действия химических окислителей и восстановителей. Различают электролиз расплавов и растворов электролитов.
Не нашли, что искали? Воспользуйтесь поиском: