
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Гетероциклические соединения
Гетероциклическими называются циклические соединения, у которых циклы составлены не только из атомов углерода, но и из атомов других элементов (гетероатомов). Наибольшее значение имеют гетероциклы, содержащие атомы азота, кислорода и серы. В состав цикла могут входить один, два, три и более гетероатомов. В зависимости от общего числа атомов, входящих в состав цикла, различают трех-, четырех-, пяти- и шестичленные гетероциклические соединения. Наибольшее значение имеют пяти – и шестичленные гетероциклические соединения.
|




 НС СН НС СН НС СН НС СН НС СН
НС СН НС СН НС СН НС СН НС СН
|
О S NН N НС N
фуран тиофен пиррол пиридин хинолин
Гетероциклические соединения проявляют в химическом поведении свойства ароматических соединений. Это объясняется наличием в их кольцах электронного секстета  -электронов. Для пятичленных циклов эта система состоит из четырех
-электронов. Для пятичленных циклов эта система состоит из четырех  -электронов, двух двойных связей цикла и одной электронной пары гетероатома. В шестичленных гетероциклах в сопряжении участвуют шесть
-электронов, двух двойных связей цикла и одной электронной пары гетероатома. В шестичленных гетероциклах в сопряжении участвуют шесть  -электронов трех двойных связей.
-электронов трех двойных связей.
Пятичленные гетероциклы
Химические свойства пятичленных гетероциклов определяются присутствием ароматического цикла, двойных связей и гетероатомов. Гетероциклы, подобно бензолу, более склонны к реакциям замещения, чем присоединения. Гетероатомы, входящие в состав цикла, оказывают влияние на свойства гетероциклических соединений. В гетероциклах, в отличие от молекулы бензола, наблюдается неравномерное распределение  -электрон-ной плотности. В фуране, тиофене и пирроле она смещена от гетероатома в сторону цикла. В результате на атомах углерода возникает значительный отрицательный заряд.
-электрон-ной плотности. В фуране, тиофене и пирроле она смещена от гетероатома в сторону цикла. В результате на атомах углерода возникает значительный отрицательный заряд.
| |||
| |||



|

|
Н
фуран тиофен пиррол
|
 -положение. Для пятичленных гетероциклов с одним гетероатомом характерна реакция взаимного обмена гетероатомами. Фуран, тиофен и пиррол могут переходить друг в друга при 4500С над Al2O3 (по Юрьеву).
-положение. Для пятичленных гетероциклов с одним гетероатомом характерна реакция взаимного обмена гетероатомами. Фуран, тиофен и пиррол могут переходить друг в друга при 4500С над Al2O3 (по Юрьеву). | |||||||||
 |  | ||||||||
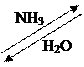 | |||||||||
| |||||||||


 S NH
S NH
O
Фуран – бесцветная жидкость, мало растворимая в воде, смешивается с органическими растворами. Фуран получают сухой перегонкой 2-фуранкарбоновой (пирослизевой) кислоты или из 2-фуральдегида (фурфурола)
| |||||
 |  | ||||
 СООН
СООН
|
| ||||||||
| |||||||||
 |  | ||||||||
 СООН
СООН
|
|
Фурановый цикл неустойчив к действию минеральных кислот. При действии серной кислоты он осмоляется, а азотная кислота, разрушая цикл, окисляет фуран в малеиновую кислоту. Поэтому при сульфировании и нитровании фурана подбирают более “мягкие ” условия.
| |||
 | |||



|
 Br Br Br
Br Br Br
O 2-бромфуран
 | |||
| |||
 SO3H
SO3H

 O
O
2-фурансульфокислота

|
|
 О
О

 OCOCH3 O2N NO2
OCOCH3 O2N NO2
O O
|

COCH3 
O
2-ацетилфуран
Фуран содержит реакционно-способные двойные связи и легче, чем тиофен и пиррол вступает в реакции присоединения.
 | |||||
 |  | ||||
тетрагидрофуран
Фурановые соединения широко используются в нефтеперерабатывающей и пищевой промышленности.
Тиофен – бесцветная жидкость, содержится в каменноугольной смоле, не смешивается с водой, хорошо растворяется в органическом растворе. Тиофен – типичное ароматическое соединение, его ароматические свойства выражены гораздо сильнее, чем у фурана и пиролла. Получают теофен из бутана и диоксида серы или паров серы.
| |||
 | |||
 CH3 – CH2 – CH2 – CH3
CH3 – CH2 – CH2 – CH3
S
| |||
 | |||
 CH3 – CH2 – CH2 – CH3
CH3 – CH2 – CH2 – CH3
S
Тиофен - самое устойчивое соединение из пятичленных гетероциклов. Он не разрушается кислотами, этому способствует более низкая электроотрицательность серы, чем у кислоты и азота, легко нитруется, сульфируется, галогенируется, алкилируется и ацилируется в  -положение, но гидрируется труднее, чем фуран.
-положение, но гидрируется труднее, чем фуран.
| |||
 | |||

 Cl
Cl
S
2-хлортиофен
 | |||
| |||
 SO3H
SO3H

 S
S
2-тиофенсульфокислота

|
 NO2
NO2
S
|
 |
 COCH3
COCH3
S
2-ацетилтиофен
Производные тиофена применяются в производстве красителей, пластификаторов, пластмасс, аналитических реагентов, инсектицидов.
Пиррол - бесцветная жидкость, быстро темнеющая на воздухе в результате окисления, частично растворим в воде и хорошо в органическом растворителе.
Пиррол можно получить сухой перегонкой аммониевой соли пирослизевой кислоты; пропусканием аммиака и паров бутандиола – 1,4 над смесью оксида алюминия и тория при 3000С.



|



 НСОН СНОН + 4Н2О + 4СО2 + NН3
НСОН СНОН + 4Н2О + 4СО2 + NН3
N
Н4NООС СООNН4 Н
 | |||
| |||

 НО–СН2–С С–СН2–ОН
НО–СН2–С С–СН2–ОН
N
Н
Основные свойства пиррола выражены слабо, несмотря на формальное сходство с амином (присутствие NH-группы). Это объясняется участием  -электронов азота в образовании
-электронов азота в образовании  -электронной системы кольца. Пиррол проявляет слабокислые свойства, взаимодействуя с калием.
-электронной системы кольца. Пиррол проявляет слабокислые свойства, взаимодействуя с калием.
 |  |
 2 + 2К 2 + Н2
2 + 2К 2 + Н2
N N
Н К
пиррол-калий
|
| |||||||
 |  |  | |||||

 СН3
СН3
N N N
К СН3 Н
N-метилпиррол 2-метилпиррол
Пиррол очень чувствителен к действию кислот. Азотная и серная кислоты его полностью разрушают.
По проявлению ароматических свойств и легкости вступления в реакции электрофильбного замещения пиррол занимает промежуточное положение между фураном и тиофеном.
| |||
 | |||

 Cl
Cl
 N
N
H
2-хлорпиррол
 | |||
| |||
 SO3H
SO3H
 N
N

 H
H
2-пирролсульфокислота
|

 N
N
 H NO2
H NO2
 N
N
H
|
 |
 COCH3
COCH3
 N
N
H
2-ацетилпиррол
При восстановлении водорода, в зависимости от условий, образуется пирролин или пирролидин.
| |||
 | |||




 N
N
H
пирролин
|

 N
N
 H
H
 N
N
H
пирролидин
Пиррол и его производные широко распространены в природе.
Индол ( -бензопирол) – конденсированное производное бензола и пиррола. Получают пропусканием паров анилина и ацетилена через на-
-бензопирол) – конденсированное производное бензола и пиррола. Получают пропусканием паров анилина и ацетилена через на-
гретую до 600-7000С трубку (метод Чичибабина).
 | |||
| |||
 СН
СН

 +
+
NН2 СН N
Н
Индол является структурным фрагментом природных соединений (индиго) и лекарственных препаратов (индопан).
Не нашли, что искали? Воспользуйтесь поиском: