
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Энтальпия образования химической реакции.
Химическую реакцию с двумя исходными веществами А1 и А2 и двумя продуктами реакции А3 и А4 можно записать:

Где  - стехиометрические коэффициенты.
- стехиометрические коэффициенты.
Пусть для продуктов реакции  3,
3,  4>0, для исходных веществ
4>0, для исходных веществ  1,
1,  2<0
2<0
Поэтому химическую реакцию можно представить в виде:

(1.25)
Изменение энтальпии для этой реакции равно разности суммы энтальпий продуктов реакции к сумме H исходных веществ.
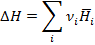
(1.26)
Важно не абсолютное значение Н в-ва, а насколько это отличается от Н других веществ, т.е. разности энтальпий продуктов реакции и исходных веществ.
Допущение:
Пусть энтальпия элемента равна нулю при любой Т.
Отсюда:
Hi вещества, находящегося в стандартном состоянии равна 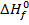 - изменению Н в реакции образования моля вещества из элементов в их стандартном состоянии.
- изменению Н в реакции образования моля вещества из элементов в их стандартном состоянии.
Например:
Н образования СО2= 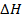 по следующей реакции.
по следующей реакции.
С(графит)+О2(газ)=СО2(газ) 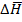 0=-94,0518 ккал/моль
0=-94,0518 ккал/моль
ð  =-94,0518 ккал/моль
=-94,0518 ккал/моль
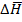 0=
0= 
Где 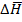 0 = теплоте полного сгорания углерода до двуокиси в избытке кислорода можно измерить точно.
0 = теплоте полного сгорания углерода до двуокиси в избытке кислорода можно измерить точно.
Поскольку энтальпия сгорания водорода до Н2О (ж.) имеет то же значение, что и энтальпия образования воды.
Если реакция образования какого-либо вещества из элементов не идет достаточно быстро, то для расчета Н образования можно воспользоваться значениями 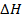 0 для ряда других реакций из которых можно составить данную.
0 для ряда других реакций из которых можно составить данную.
Изменение стандартной Н для реакций можно рассчитать из Н образования по уравнению:
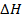 0=
0= 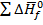
(1.27)
Энтальпии образования многих соединений, ионов известны с большой точностью. Они сведены в таблицы. Пользуясь этими энтальпиями образования можно рассчитать изменения энтальпии для большого числа реакций по уравнению 1.27.
Не нашли, что искали? Воспользуйтесь поиском: