
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Молекулалық физика нені зерттейді? Молекулалық физиканың қандай салаларын білесіз? Идеал газ бен реал газды салыстырыңыз.
Молекулалық физика – физиканың әр түрлі агрегаттық күйдегі заттардың физикалық қасиеттерін олардың молекулалық құрылысы негізінде зерттейтін саласы. Молекулалық физиканың ең алғаш қалыптасқан бөлімі – газдардың молекулалық-кинетикалық теориясы. Бұл теория 1858 – 60 жылдары Дж.Максвеллдің, 1868 жылы Л.Больцман және 1871 – 1902 жылдары Дж.Гиббс еңбектерінің нәтижесінде классикалық - статистикалық физика болып қалыптасты. Молекулалардың өзара әсері (молекулалық күштер) жөніндегі сандық мәліметтер капиллярлық құбылыстар теориясында: 1743 жылы А. Клероның, 1805 жылы Т.Юнгтың, 1806 жылы П.Лапластың,С.Пуассонның, т.б-дың классикалық еңбектерінде дамытылып, беттік құбылыстар теориясының жасалуына негіз болды. Голланд физигіЯ.Ван-дер-Ваальс нақты газдар мен сұйықтықтардың физ. қасиеттерін түсіндіру үшін молекула аралық өзара әсер ұғымын (1873) пайдаланып нақты газдардың күй теңдеуін (Ван-дер-Ваальс теңдеуі) қорытып шығарды. 1906 жылы француз физигі Ж.Перрен мен швед ғалымы Т.Сведбергтің, 1904 – 06 жылы поляк физигі М.Смолуховский мен А.Эйнштейннің микробөлшектердің броундық қозғалысына және заттардың молекулалық құрылысына арналған зерттеу жұмыстары кез келген заттың молекулалардан тұратындығының айғағы болды. Осы мақсатта көптеген ғалымдар алғашқыда заттарға түсірілген рентген сәулесінің дифракциясын, кейіннен электрондар мен нейтрондар дифракциясынпайдаланып, нәтижесінде қатты денелер мен сұйықтықтардың құрылысы жөнінде нақты мәліметтер алды. Кванттық механикада молекула аралық өзара әсер туралы ілім 1927 жылы Ф.Лондонның, 1927 жылы В.Гейтлердің, 1930 жылы П. Дебайдың, 1937 – 39 жылы М.Борнның еңбектерінде дамытылды. 19 ғасырда Я.Ван-дер-Ваальс пен У.Томсон (Кельвин) байқаған және Дж.Гиббс пен 1937 жылы Л.Ландаудың еңбектерінде дамытылған бір агрегаттық күйден екінші агрегаттық күйге ауысу теориясы фаза түзілудің қазіргі теориясына айналды; сөйтіп ол молекулалық физиканың маңызды жеке тарауы болып қалыптасты. Я.И. Френкельдің, Дж.Берналдың, т.б. еңбектерінде статистик. әдістің заттардың құрылымы жөніндегі көзқараспен біріктірілуі сұйықтықтар мен қатты денелердің молекулалық физикасының дамуына үлкен әсер етті.
Молекулалық физика нені қамтиды?[өңдеу]
Мұнда газдардың, сұйықтықтардың және қатты денелердің құрылысы, олардың сыртқы әсерлердің (қысым, температура, электр және магнит өрістері) нәтижесінде өзгеруі, тасымалдау құбылысы (диффузия, жылуөткізгіштік, ішкі үйкеліс), фазалық тепе-теңдік және ауысу процестері (кристалдану және балқу, булану және конденсация, т.б.) заттардың кризистік күйі, әр түрлі фазалардың бөліну шекараларындағы беттік құбылыстар қарастырылады. 20 ғасырда молекулалық физиканың жедел қарқынмен дамуы нәтижесінде одан статистикалық физика, физ. кинетика, қатты денелер физикасы, физ. химия тәрізді ірі, өз алдына дербес салалар бөлініп шықты. Қазіргі ғылым мен техниканың жаңа заттар мен материалдарды кеңінен пайдалануының нәтижесінде заттар құрылысын зерттеудің сан алуан әдістері пайда болды. Заттардың және олардың зерттеу әдістерінің әр түрлі болуына қарамастан молекулалық физика заттар құрылысының микроскопиялық (молекулалық) сипатына негізделе отырып, олардың макроскопиялық қасиеттерін зерттейді.
Газ [1](фр. gas, гр. chaos – бей-берекет) — заттың атомдары мен молекулалары бір-бірімен әлсіз байланысқандықтан, кез келген бағытта еркін қозғалатын және өзіне берілген көлемге толық жайылып орналасатын агрегаттық күйі. «Газ» атауын ғылыми қолданысқа 17 ғасырдың басында голланд ғалымы Ян Баптист ван Гельмонтенгізген. Газ молекулаларының соқтығысу уақыты олардың еркін жолға кететін уақытынан әлдеқайда аз болады. Химиялық элементтердің өте кіші бөлшекке бөлініп, бейтарап ұшуы. Негізгі тұрмыстағы газдар пропан, бутан, неон және тағыда басқа Газ қатты дене мен сұйықтық тәрізді еркін бет түзбейді және ол берілген көлемді толық толтырып тұрады. Газ тәрізді күй – заттардың (жұлдызаралық заттар, тұмандықтар, жұлдыздар, планеталардың атмосферасы, тағыда басқа) ғаламдағы ең көп таралған күйі. Химиялық қасиеттері бойынша газдар және олардың қоспалары (активтілігі аз инертті газдар мен қопарылғыш газдар қоспасына дейін) сан алуан болып келеді. Газға атомдар мен молекулалардан тұратын жүйе ғана емес, кейде басқа бөлшектерден – фотондардан, электрондардан, броундық бөлшектерден, сондай-ақ плазмадан тұратын жүйелер де жатқызылады.
Нақты (реал) газдар. Газдың тығыздығы артқан сайын оның қасиеттері идеал газ күйінен ауытқи бастайды. Бұл жағдайда соқтығысулардың рөлі артып, молекулалардың мөлшерлері мен олардың өзара әсерлерін ескермеуге болмай қалады. Мұндай газды нақты (реал) газ деп атайды.
Газ алмасу, биологияда – ағза мен оны қоршаған орта арасындағы газ алмасу процесі. Адам мен жануарлар ағзасы тыныс алу кезінде сыртқы ортадан оттекті сіңіріп, өзінен көмі қышқыл газын және зат алмасу нәтижесінде пайда болатын әр түрлі газ қоспаларын сыртқа шығарады. Газ алмасусыз тірі ағзада зат және энергия алмасуы дұрыс жүрмейді. Зат алмасу процесінің нәтижесінде ағза сіңірген қоректік заттардың (белок, көмірсу, май) құрамындағы химиялық энергия бөлініп, ағзаның тіршілік әрекетіне қажетті энергияға (мысалы, 1 литр оттек 4,7 – 5,0 ккал жылу береді) айналады. Организм пайдаланатын оттек пен одан бөлініп шығатын көмір қышқыл газдың мөлшері адамның жасына, тіршілік әрекетіне, атқаратын қызметіне, сыртқы ортаның температурасына және тағамның құрамына байланысты өзгеріп тұрады. Адам жұмыс істегенде, ауа райы салқындағанда, калориялы тамақ ішкенде ағзадағы газ алмасу күшейе түседі. Демалыс кезінде, ұйықтағанда газ алмасу төмендейді. Газ алмасу арқылы ағзадағы энергия мөлшерін анықтауға болады. Газ алмасу процесі кезінде ағза оттекті көп мөлшерде пайдаланса, барлық дене мүшелерінің қызметі артып, тыныс алу және қан айналысы жақсарады, осыған байланысты қанның физикалық-химиялық құрамы да өзгереді. Газ алмасу бір клеткалы қарапайымдыларда, олардың бүтіндей денесі арқылы, көп клеткалы жануарларда арнаулы тыныс мүшелері (кеңірдек, желбезек, өкпе) арқылы жүреді. Өсімдіктердегі газ алмасу жануарлар мен адам ағзасындағыдан өзгеше болады. Тірі азғалар сияқты өсімдіктер де барлық мүшелері арқылы тыныс алады, тыныс алу процесі өсімдіктің өсіп келе жатқан жас мүшелері мен тіндерінде, әсіресе, жапырақтарында күшті, ал сабағы мен тамырында баяу жүреді. Өсімдіктер тыныс алған кезде, керісінше, ауадан көмір қышқыл газ сіңіріліп, оттек бөлінеді. Химиялық заттардың кейбіреулері газ күйінде болады, мысалы, Н2, O2, N2, Сl2, т.б. Бұлардан басқа күрделі заттар да газ күйінде бола алады: СO2, SO2, СН4, HCl, H2S, т.б. Газ күйіндегі заттар газ заңдарына бағынатыны белгілі, оларды сендер физика курсынан білесіңдер.
Газдардың күйін сипаттайтын шамалар: қысым, көлем, температура. Газдарды сипаттағанда көбінесе қысым мен температураны тұрақты етіп алып, көлемнің өзгерістерін қарастырамыз, көлемнің өзгерісі газдар үшін деңгейлес болады, себебі олардың молекулааралық қашықтықтары шамамен бірдей.
Физика курсынан тығыздық дегеніміз газдың көлем бірлігінің массасы екендігін білесіңдер:
 г/л бұдан
г/л бұдан 
Аралас газ[өңдеу]
Қатты отынды ауа және су буының қоспасымен газдандыру кезінде түзілетін газ тәрізді өнім.
Ауа газы[өңдеу]
Газ тәрізді заттардың қоспасы; қатты отындарды ауамен газдандыру кезінде алынады, өндірістік пештерде отын ретінде қолданылады.
Картерлық газ[өңдеу]
Картерлық газ - цилиндрлардан поршень сақиналары арқылы іштен жанатын қозғауыштың картеріне өтіп, май буларымен араласқан газ.
Газды бөліп тарату[өңдеу]
Газды бөліп тарату - қозғауышқа жаңғыш қоспаны толтыру және жанармай жанғанда пайда болатын газды шығару үрдісі.
Газдар[өңдеу]
Газдар - газды қара.
Пайдаланылған газдар[өңдеу]
Пайдаланылған газдар-пайдалы жұмысты жасағаннан кейін қозғауыштан шығарылатын газдар.
Тығыздалған газдар[өңдеу]
Тығыздалған газдар - автомобиль қозғауыштарының отыны, әдетте бұл табиғи газдар,20 МПа қысымдағы метан.
Сұйықталған газдар[өңдеу]
Сұйықталған газдар - автомобиль қозғауыштарыньщ отыны, әдетте бұл 1,6 МПа жуық қысымдағы пропан мен бутан.
Идеал газ – бөлшектерінің өзара әсері ескерілмейтін газдың теориялық моделі.
Ол классикалық идеал газ және кванттық идеал газ болып ажыратылады. Классикалық идеал газдың қасиеттері классикалық физика заңдарымен – Клапейрон теңдеуімен, сондай-ақ оның дербес түрлері Бойль–Мариотт заңы және Гей-Люссак заңыменсипатталады. Классикалық идеал газ бөлшектерінің энергиясы Больцман үлестірілуіне сәйкес болып үлестіріледі. Жеткілікті дәрежеде сиретілген реал газдар классикалық идеал газдың моделімен жақсы түсіндіріледі.[1]
Газдың температурасы төмендеген немесе оның тығыздығы артқан кезде идеал газ бөлшектерінің толқындық (кванттық) қасиеттері елеулі рөл атқара бастайды. Бүтін санды спинді бөлшектерден құралған кванттық идеал газдың қалпы (күйі) Бозе – Эйнштейн статистикасымен, ал жарты бүтін санды спинді бөлшектерден құралған кванттық идеал газдың қалпы (күйі) Ферми–Дирак статистикасымен сипатталады.[2]
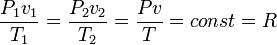
мұндағы R - меншікті газ тұрақтылығы. Мұндағы шамалар мына бірлікте: Р - Н/м2, v - м3/кг; Т - К, R - Дж/(кгК). Теңдеу біртекті газдардың қалай болса солай алынған санына m арналғанын, басқа түріндегі теңдеуін пайдалана отырып жазуға болады:

Бұл теңдеу, идеалды газдарға арналған Клапейрон-Менделеев теңдеуі деп аталады. Мейлі, М газдың молярлы массасы, кг/моль, өлшенеді.
Авогадро заңы бойынша, идеалды газдың 10−3 көлемі - қандай да химиялық құрамындағы р және t бірдей кезінде, дәл өзі болады. Белгілі, қысым кезінде р0 = 101,33 Па (760 мм.сын.бағ.) және температурада T0=273,16К (нормалы физикалық күйде), газ көлемі 10−3 моль кезінде, Vm = 22.4116 м3. р0, Vm, Т0 және M=m мәндерін теңдеуіне ауыстырып қойып табамыз:
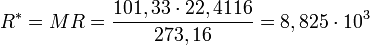 Дж/(моль*К)
Дж/(моль*К)
Мұндағы R* барлық газдар үшін бірдей және оны, эмбебапты газ тұрақтылығы деп атайды. Сонымен:
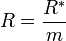
Идеалды газдар қоспасы[өңдеу]
Жылулықты қолданатын машиналардың жұмыстық денесі ретінде, әртүрлі газдардың қоспасын қолданады.
Олар үшін, Rқос болуы қажет. Әрбір құрамды бөлікке кіретін қоспалар, қоспаның толық көлемімен толады, бірақ, онда олар өзінің парциалды қысымында болады:
Дальтон заңы бойынша

Газды қоспаның т массасы үшін, дұрысында дәл осындай түріндегі теңдеу түрі:

Бірақта, меншікті газ тұрақтылығы R, мұндағы қоспалар құрамына байланысты және бір және сол газдар қоспалары, олардың құрамдары өзгерген кезде, әртүрлі мәндерінде болады.
Қоспалардың, меншікті газ тұрақтыларын былай анықтайды. Қоспалар п, әртүрлі құрамды бөлікті газдардан тұрғандағы, әрқайсысының m1, m2, m3,...., mn массасында болғанда, қоспа массасын, мына түрінде шешеді:
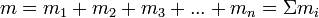
Жеке құрамды (газдар) парциалды қысымдарды Р1, Р2, Рз,…, Рn деп белгілейді. Газды қоспалардың, жеке газдардағы парциалды қысымы ұғымындағы қысым сол санында, сол көлемде және сондай температура кезінде, қоспа жағдайымен бірдей болуы тиіс. Сондықтан, біртекті газдар үшін мына теңдікте жүреді
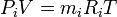
Мұндағы Рi, mi, Ri - қаралып отырған газды қоспалардың парциалды қысымы, массасы, меншікті газ тұрақтылығы; V, T қоспаның көлемі мен температурасы.
Газды қоспаның әрбір құрамды бөлігіне жағдай теңдеулерін жазамыз:

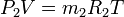
..............................
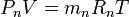
Осы теңдіктердің оң және сол бөліктерін мүшелеп қосып, табамыз:
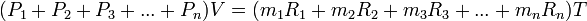
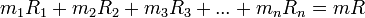 деп белгілеп табамыз.
деп белгілеп табамыз.

Мұндағы:

Газ қоспаларының техникалық көрсеткіштерін, сонымен қатар, оның көлемдік құрамының көмегімен жиі анықтайды, оны анықтау былай қабылданған. Қоспа қысымы Р мен Т температурасы кезіндегі, әрбір қоспаның құрамды бөлшектерін жеке түрінде қарастырамыз. Сонымен, құрамды бөлшектердің парциалды көлемдері V1, V2, V3,,...Vn жағдай теңдеуіне сәйкес, қатаң түрде белгілі мәндерде болуы тиіс:


..............................
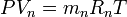
Осы теңдеулерді қосып мүшелеп табамыз:
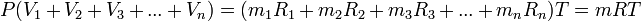
Сонымен газды қоспа үшін PV=mRT, онда:
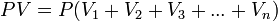
немесе:
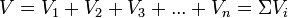
Формула газ қоспасының көлемдік құрамын анықтау негізіне жатады. Одан
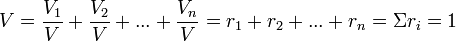
Идеалды газдар және олардың қоспаларының жылу сыйымдылығы[өңдеу]
Денелердің жылу сыйымдылығы дегеніміз, оның температурасын 1°К өзгертуге арналған, қажетті жылу санын айтады. Заттардың санына байланысты, мына меншікті жылу сыйымдылығын пайдаланады: С - массалы жылу сыйымдылығы, бір килограмм массаның Дж/(кгК) жатуы; МС - молярлы жылу сыйымдылығы, 1 мольдың Дж/(к мольК) жатуы;
С’ - көлемдік жылу сыйымдылығы, 1 м3 Дж/(м3К) нормалы жағдайда жатуы:
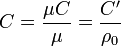
P=const кезіндегі, массалы жылу сыйымдылығы, Ср - белгілейді және оны изобарлы деп атайды, ал V=const кезіндегісін Cv - белгілеп және оны изохорлы деп атайды. Сржәне Cv аралық байланысын Майер теңдеуі арқылы беріледі:

Молярлы жылу сыйымдылығы үшін Майер теңдеуі, мына түрде болады:
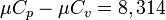
8,314 - әмбебапты газ тұрақтылығы, кДж/(к мольК)
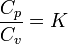
K - адиабаттар көрсеткіші.
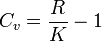
Реал газ - қасиеттері молекулалардың өзара әсерлесуіне тәуелді (идеал газдан айырмашылығы) газ; молекулаларының арасындағы өзара әсерлесулер маңызды роль атқаратын газдар.[1]
Қарапайым жағдайда молекулааралық өзара әсердің орташа потенц. энергиясы молекуланың орташа кинетик. энергиясынан көп кіші болса, онда Реал газ бен идеал газдың бір-бірінен айырмашылығы өте аз болады. Газдардың бұл қасиеттеріндегі айырмашылық жоғары қысым мен төмен температураларда байқалады.
Молекула – кинетикалық теорияның негізгі үш қағидасы қандай? «Броундық қозғалысты» қалай түсінесіз? Мысал келтіріңіз.
Газдардың физикалық қасиеттерін зерттеуге статистикалық әдісті қолданайық.
Молекула –кинетикалық теорияның негізгі қағидалары:
1. Барлық заттар бөлшектерден тұрады (молекулалар мен атомдардан);
2. Осы бөлшектер тәртіпсіз, хаостық қозғалыста болады. Бұл қозғалыс жылулық қозғалыс деп аталады;
3. Бөлшектер бір-бірімен өзара әсерлеседі.
Зат бөлшектерінің жылулық қозғалысын қөрнекі түрде көрсететін тәжірибені ағылшын ғалымы Броун жасады. Броун микроскоптың көмегімен сұйықта қалқыған гүл тозаңдарының жылдам, тәртіпсіз қозғалысын бақылады. Осындай зат бөлшектерінің жылулық қозғалысын Броундық қозғалыс деп атайды.
Макроскопиялық параметрлердің (қысым, көлем) микроскопиялық параметрлермен (молекулалардың массасы, жылулық қозғалыс жылдамдығы, кинетикалық энергиясы) арасындағы байланысты көрсететін өрнекті молекула-кинетикалық теорияның негізгі теңдеуі деп атайды.
Броундық қозғалыс, браундық қозғалыс — сұйық не газ ішіндегі ұсақ бөлшектердің қоршаған орта молекулаларыныңсоққысы әсерінен болатын бей-берекет қозғалысы. Мұны 1827 жылы ағылшын ғалымы Р. Броун (Браун) зерттеген.
Броундық қозғалыстың қарқындылығы уақытқа тәуелді емес. Бірақ ортаның температурасы жоғарылаған сайын және ортаның тұтқырлығы мен бөлшектердің мөлшері кеміген сайын Броундық қозғалыстың қарқындылығы артады. Броундық қозғалыстың толық теориясын 1905 — 06 жылы А. Эйнштейн және поляк физигі М. Смолуховский жасады. Броундық қозғалыстың болу себебі — орта молекулаларының жылулық қозғалысы және бөлшектердің орта молекулаларымен соқтығысуы кезінде алатын импульстерінің теңгерілмеуі. Орта молекулаларының соққысы бөлшектерді бей-берекет қозғалысқа келтіріп, олардың жылдамдығының шамасы мен бағытын шапшаң өзгертіп отырады. Егер бөлшектердің орны бірдей қысқа уақыт аралықтарында тіркеліп отырса, онда бөлшектердіңтраекториясы күрделі екендігі байқалады (суретті).
Броундық қозғалыс атомдар мен молекулалардың бей-берекет жылулық қозғалысы жөніндегі молекула-кинетикалық теорияның) жеткілікті ұзақ болса және орта молекулаларының бөлшекке әсер ету күші өзінің бағытын бірнеше рет өзгертсе (сыртқы күш әсер етпеген жағдайда), онда қандай да бір оське бөлшек ығысуы проекциясының орта квадраты төмендегі формуладан анықталады (tең көрнекті дәлелі болып есептеледі. Егер бақылау уақыты (Эйнштейн заңы мұндағы D —,t): =2D диффузия коэффициенті. Радиусы а-ға тең сфералық —ha, мұндағы hpбөлшек үшін: D=kT/6 ортаның динамикалық тұтқырлығы, Т — температура. Эйнштейн заңындағы мен D шамаларының бір-біріне қатысы француз физигі Ж. Перрен мен швед физигі Т. Сведбергтің тәжірибелерінде дәлелденді. Соның нәтижесінде Больцман тұрақтысы жәнеАвогадро тұрақтысы тәжірибе жүзінде нақтыланды. Броундық қозғалыс теориясы физикалық-химиялық дисперсті жүйеде қолданыс тапты. Ал метрологияда Броундық қозғалыс сезгіш құралдардың дәлдігін анықтайтын негізгі фактор болып есептеледі.
Үздіксіз қозғалыс[өңдеу]
Көптеген тәжірибелер заттар мен денелерді құрайтын бөлшектердің үздіксіз қозғалыста болатынын дәлелдеді. Мысалы, өткір иісті затты бөлмеге алып кірсе, оның иісі сол уақытта ягни тез арада бөлме ішіне таралып кетеді. Бұдан затты құрайтын ұсақ бөлшектер үздіксіз қозғалыста болады деп жорамалдауға болады. Алайда ғылыми жорамалдың ақиқаттығын көптеген тәжірибелер жасап, тексеру қажет. Тек сынақ-тәжірибе ғана жорамалдың дұрыс немесе бұрыстығын анықтауға мүмкіндік береді. Мысалы, тар саңылаудан қараңғы бөлмеге түскен жарық жолағына көз салсаң, ауадағы шаң тозаңдарының ретсіз әрі үздіксіз қозғалыста болатынын көресің. Бұл бөлшектер, әрине, ауадағы молекулалар емес. Бірақ ауа құрамындағы көзге көрінбейтін сансыз көп молекулалар мен атомдар үздіксіз және ретсіз қозғала жүріп, ауадағы шаң тозаңдарын үнемі ретсіз қозғалыста болады.
Сөйтіп, ауадағы тозаңдардың ретсіз қозғалысы молекулалар мен атомдардың үздіксіз қозғалысының салдары болып табылады.
Сұйық зат бөлшектерінің де үнемі қозғалыста болатынын тәжірибе арқылы байқауға болады. Мысалы, шыны ыдыстағы тотияйын ерітіндісінің үстіне жайлап қана таза суқұяйық. Сонда қоңырқай көкшіл түсті ерітінді мен мөлдір судың ара жігі айқын көрініп тұрады. Біраз күн өткеннен кейін ыдыстағы сұйықтың бір түске енгенін көреміз. Өйткені тотияйын бөлшектерін су молекулалары үздіксіз соққылап, оларды да үздіксіз әрі ретсіз қозғалуға мәжбүр етеді. Сөйтіп тотияйын бөлшектері судың барлық көлеміне тарап, араласып кеткен. Бұл тыныштықта тұрған ыдыстағы сұйық молекулаларының да үздіксіз әрі ретсіз қозғалыста болатынын дәлелдейді.
Диффузия[өңдеу]
Бір заттың молекулаларының екінші заттың молекулаларының араларындағы бос орындарға өтіп таралуын диффузия (латынша жайылу, таралу) деп атайды.
Қатты денелерде де диффузия құбылысы байқалады. Түйісетін беттері мұқият тегістелген қорғасын мен алтынды бір-біріне беттестіріп, бірнеше жыл өткеннен кейін карағанда олар бір-бірімен тұтасып калған. Сөйтсе, 5 жыл ішінде бөлме температурасында түйісіп тұрған беттегі алтын мен қорғасын бөлшектері бір-біріне 1 мм тереңдікке дейін еніп кеткен.
Тұрмыста, табиғатта және адам мен жан-жануарлар әлемінде диффузияның пайдалы да, зиянды да жақтары бар. Мысалы, ауадағы оттегі суға диффузия арқылы өтетіндіктен, ондағы жануарлар дем алып, тіршілік ете алады. Нақ осы жолмен ауадағы оттегі адам терісінен өтіп, оның организмін сауықтырады. Міне, сондықтан адам денесі терісінің үнемі таза болуы денсаулыққа жақсы әсер етеді. Қоректік заттар диффузия арқылы жануарлардың қарнынан, ішегінен өтіп, қанға беріледі. Одан әрі қан тамырларының қабырғаларынан етіп, бүкіл денеге тарайды. Диффузияның зиянды жақтарына келер болсақ, ауру тарататын микробтар, әр түрлі улағыш заттар (темекі түтіні, арақ пен есірткі молекулалары) адам организміне оңай сіңіп, зор зиян келтіреді. Мысалы, адам темекіні қанша рет сорса, сонша минут оның өмірі қысқарады. Есірткі естен тандырып, арақ аздырып адамды қыршынынан қияды. Сондықтан айнала қоршаған ортаның, өз денеңнің тазалығын сақтау, зиянды әдеттен аулақ болу әркімнің қасиетті міндеті.
Диффузия құбылысынан мынадай қорытынды туады: денелерді құрайтын бөлшектер бір-бірінен белгілі бір қашықтықта орналасады және үздіксіз қозғалыста болады. Дене көлемінің үлкен бөлігін бос кеңістік алып тұрады. Тіпті, біртұтас атомныңда аса үлкен бөлігі бос кеңістік болып табылады. Атом көлеміндегі бос орынды салыстырмалы түрде көз алдына елестету үшін мына мысалды келтірейік: атомның ядросын шие көлеміндей үлкейтсек, онда осы шие - ядроны айнала қозғалатын атом электрондарының орбиталары үлкен футбол стадионындай болар еді. Ядроның кішілігі сондай, ол атом көлемінің 1/1 000 000 000 000 = 10 12 бөлігін ғана алады. Денелерді қыздырғанда диффузия жылдамырақ жүреді. Өйткені денелерді құрайтын бөлшектердің қозғалыс жылдамдығы оларды қыздыра түскен сайын арта береді.
Ауаның жылынуы мен салқындауы, мұздың еруі, судың буға айналуы, металдардың балқуы, газдардың сұйылуы — осылардың барлығы да денелердің жылулық күйінің өзгерісін білдіреді. Дененің немесе заттың жылулық күйін сипаттайтын физикалық шама температура деп аталады.
Денелердің температурасы[өңдеу]
Денелердің температурасын термометрмен өлшейді. Температураны өлшегенде Цельсий немесе Кельвин шкалалары қолданылады. Температураның өлшем бірлігін градус деп атайды. Цельсий шкаласындағы градус (°С) деп, ал Кельвин шкаласы бойынша - (К) деп белгіленеді. Денелердің температурасы тұрмыста Цельсий шкаласында көрсетілген градуспен (°С) өрнектеледі. Ғылыми зерттеулерде көбіне Кельвин шкаласын (К) пайдаланады. Мұздың еру температурасы Цельсий шкаласында нөл градус (0°С) деп алынады. Кельвин шкаласындағы нөл градус (К) Цельсий бойынша минус градуска (-273°С) тең. Бұл гелий газының қатты күйге айналу температурасына сәйкес келеді. Будың суға, одан мұзға айналатыны сияқты, газдарда өте төмен температурада сұйық күйге, одан қатты күйге ауыса алады.
Температураға байланысты тәжірибелер[өңдеу]
Көптеген тәжірибелер денелердің температурасы олардың құрамына кіретін молекулалардың қозғалыс жылдамдығына байланысты өзгеретінін дәлелдеді. Мысалы, қантпен тұз суық суға қарағанда ыстық суда тезірек ериді. Оның себебі: ыстық судың молекулалары салкын судың молекуласына қарағанда жылдамырақ қозғалады. Сөйтіп қант бөлшектерін ыстық су молекулалары жиі-жиі соққылап, тездетіп ерітеді. Екі металды түйістіріп, балқыта қыздырсақ, олар бірімен-бірі берік тұтасып қалады. Өйткені молекулалардың қозғалыс жылдамдығы артады да, екі металдың бөлшектерінің бір-біріне өтуі шапшаңдайды. Бұл құбылысты шеберханадағы ұсталар металдарды өңдеп, әр түрлі бұйымдар жасау үшін пайдаланады.
Тәжірибе нәтижелерін былайша корытындылаймыз: дене молекулаларының қозғалыс жылдамдығы неғұрлым үлкен болса, оның температурасы да соғұрлым жоғары болады. Міне, сондықтан температура дененің немесе заттың жылулық күйін сипаттайтын физикалық шама болып табылады
Дене құрылымының молекулалық кинетикалық теориясы деп барлық денелер жеке бейберекет қозғалыстағы бөлшектерден тұрады деген көзқарас негiзiнде макроскоптық денелердiң қасиеттерi мен жылу процестерiне түсiнiк беретiн iлiмдi айтады.
§ 1.2 Молекуллар массасы мен өлшемi. Салыстырмалы молярлық және молекулалық масса. Авогадро саны.
Әртүрлi денелер молекуласының масса бiрлiгi ретiнде 12С көмiртегi изотобы атомының mocмассасының 1/12 бөлiгi алынады. Ол атомдық масса бiрлiгi (а.м.б.) деп аталады және мынаған тең...
§ 1.3 Молекулалар арасындағы өзара әсерлесу күштерi. Сұйық, газ тәрiздес және қатты денелердiң құрылымы
Молекулалар қозғалыс кезiнде бiр-бiрiмен өзара тартылыс және тебiлiс әсерiнде болады. 1.3 суретте молекулалық өзара әсерлесу күштерiнiң таралуы молекулалар арасындығы r арақашықтықтан тәуелдiлiгi келтiрiлген. Тартылу және тебiлу күштерi r-дан тәуелдiлiгi әртүрлi, сондықтан олардың қорытқы күшi нөлден өзгеше. Белгiлi бiр r = r0 арақашықтықта тебiлу күшi арасында тепе-теңдiк орнайды. Молекулалардың диаметрiмен салыстырылатын бұл арақашықтық тепе-теңдiк жағдайына сәйкес келедi. r < r0 болғанда тебiлу күшi тартылу күшiнен басым болады. Сондықтан молекулалар бiр-бiрiне ене алмайды. Олардың арасындағы арақашықтық r > r0 өскен сайын, молекулалардың тартылуы тебiлуiн жеңе бастaйды. Олардың ыршып кетуiне жол бермейдi. r >> r0 кезiнде, молекуларалық күштердiң әсерi болмайды.
§ 1.4 Газдың молекулалық-кинетикалық теориясының негiзгi теңдеуi
Идеал газ деп молекулалардың өзара әсерлесуi ескерусiз аз шама болғанда айтады. Молекулалардың өзара әсерлесуi олардың соқтығысуы кезiнде серпiмдi ұрылуы түрiнде байқалады.
§ 1.5 Газдың макропараметрлерi. Tемпература және оны өлшеу
Дененiң молекулалық-кинетикалық құрылымы ескерiлмегенде макроскоптық дене күйiн сипаттайтын шамаларды макроскоптық параметрлер деп атайды.
Бұндай шамалар қатарына көлем V, қысым P, температура T және басқалар. Көлем мен қысым механикалық сипатталатын шамалар. Температура дененiң қызу дәрежесiн бередi, оның iшкi энергетикалық күйiн анықтайды.
Егер қандайда бiр оқшауланған жүйенi құрайтын денелер температурасы бастапқы уақытта әртүрлi болса, онда уақыттың келесi мезеттерiнде олар бiртiндеп теңесе бастайды да ақырында бiрдей болады, денелер арасында жылулық тепе-теңдiк орнайды.
§ 1.6 Температура - идеал газ молекуласының орташа кинетикалық энергиясының өлшемi
Барлық газдар жылу тепе-теңдiгi кезiнде температуралары бiрдей болады. Молекулалардың жылулық қозғалысы сөз болғандықтан, температураны молекулалық деңгейдегi физикалық шамалар арқылы жазу керек. Бұндай шама ретiнде молекуланың iлгерлемелi қозғалысының кинетикалық энергиясын алуға болады. Бұл жорамал үш ыдыспен жасалған тәжiрибеде толық дәлелденедi.
§ 1.7 Газ молекуласының жылдамдығы. Штерн тәжiрибесi
Газ температурасы белгiлi болса, онда оның молекуласының қозғалысының орташа түзу сызықты жылдамдығын есептеуге болады. теңдеуiмен орташа кинетикалық энергия анықтамасынан теңдiгiмен теңестiрiп жылдамдықтың орташа квадраты үшiн келесi өрнектi аламыз:. Бұл шамадан алынған квадраттық түбiр орташа квадраттық жылдамдық деп аталады
§ 1.8 Больцман тұрақтысы. Клайперон-Менделеевтiң күй теңдеуi
Температура үшiн pV/N = kT түрiндегi формуланы практикада пайдалану пропорционалдық коэффициенттiң k сандық мәнiн бiлудi қажет етедi. Оны табуға болады, егер тәжiрибелерден белгiлi мәлiметтердi пайдаланса. Атап айтқанда, үш ыдыспен жасалған тәжiрибеден: V = 0.1м3 көлемдi алатын сутегiнiң бiр молi үшiн, θ= pV/N шамасы температураның T1=273oК мәнiнде мынаған тең θ0 = 3.76•10-21 Дж, ал T2=373oК болғанда – θ100 = 5.14•10-21 Дж. Температураның осы мәндерiндегi айырмасын θ= kT өрнегiн пайдаланып жазсақ, шығатыны θ100 – θ0 = k(Т2 – Т1) немесе (5.14 –3.76)•10-21 Дж = k•100o К. Бұдан
§ 1.9 Газдағы изопроцесстер және олардың графиктерi.
Параметрлерiнiң бiрiнiң шамасы өзгерiссiз өтетiн процестердi изопроцестер деп атайды. Газдың үшiншi параметрi тұрақты болған кездегi екi параметрi арасындағы мөлшерлiк байланысты (тәуелдiлiктi) газ заңдары деп атайды.
Теориялық физика — табиғатты тану үшін ондағы болып жатқан құбылыстардың математикалық моделін жасап, оны шындықпен салыстыру әдісін қолданатын физиканың бөлімі. Мұндай анықтама аясында теориялық физика табиғаттанудың жеке әдісі болып табылады. Алайда оның зерделеу аумағы жасалған тәжірибелер мен табиғатта болып жатқан құбылыстарды ескере отырып пайда болады. Басқаша айтар болсақ, теориялық физика — физикалық құбылыстарды және оларды сипаттайтын заңдарды бір-бірімен өзара байланыстыра отырып түсіндіретін жүйелі білім Математикалық физика теориялық физикаға жақын сала болып табылады, бірақ ол математикалық моделдерді математиканың қатал деңгейде зерттеп, оны табиғаттағы нақты жағдайлармен салыстырмайды.
Сипаттамасы[өңдеу]
Адамдар табиғат құбылысын зерттей отырып, негізінен мына үш сұрақка жауап іздейді. Қандай құбылыс жүріп жатыр? Қалай жүріп жатыр? Неге бұлай жүріп жатыр? Бірінші сұраққа жауап алу үшін бақылау жүргізеді. Екінші сұрақта эксперименттің рөлі арта түседі. Ал соңғы сұраққа негізгі жауапты физикалық теориядан аламыз. Сөйтіп, физикалық теорияның негізгі қызметі құбылысты түсіндіру болып табылады.
Физикалық теория құрамына: құбылыстың сипаттамасы, эксперименттердің нәтижелері, ұғымдар, негізгі идеялар, модельдер, болжамдар, заңдылықтар, зерттеу әдістері (математикалық әдістер де) кіреді. Теориялық зерттеу әдістерінің негізіне адамның ой қорытуы жатады. Физикалық құбылыстардың сипатына қарай физикалық теориялар да әр түрлі болып келеді. Алайда, физикалық құбылыстарды, олардың сан алуандығына қарамастан, бірнеше іргелі физикалық теориялар теңірегінде ғана топтастыруға болады. Төменде олардың қандай құбылыстарға арналатыны масалдармен келтірілген:
· Жылдамдығы аз, ірі (макроскопиялық) денелердің механикалық қозғалысына байланысты кұбылыстарды Ньютонның классикалық механика теориясы түсіндіреді.
· Жылулық құбылыстарға байланысты сұрақтарды термодинамика және молекулалық физика теориясынан ұғынуға болады. Бұл теория мынадай сұрақтарға да жауап береді: денелер қызғанда неге ұлғаяды? Ыстық шайға салған қасық неліктен қызады? Heгe бір дене жылуды жақсы, ал екіншісі нашар өткізеді?
· Электрлік және магниттік құбылыстар, солардың ішінде радиотолқындардың алынуы мен таралуы, сондай-ақ электромагниттің қасиеттері және электр тогының пайда болуы электродинамика теориясында баяндалады.
· Өте жылдам козғалатын, көзге көрінбейтін элементар бөлшектерге байланысты құбылыстарды кванттық механика теориясы түсіндіре алады. Мектептегі физика пәні бүл теориялар туралы жалпы мағлұмат береді.
Теориялык әдістердің басқа әдістерден басты ерекшелігінің бірі - еуристикалық (болжағыштық) пайымдаулар жасай алуы. Ғылыми теориялар құбылысты түсіндіріп қана қоймайды, олардың келешекте қалай өтетінін алдын ала болжап айтуға да мүмкіндік береді.
Тарихы[өңдеу]
Физикалық теорияның тарихи дамуына мысал ретінде заттың құрылысы туралы молекулалы-кинетикалық теорияның қалыптасуын алуға болады.
Ежелден-ақ адамдарды табиғаттағы заттардың түрленуі, бір күйден екінші күйге ауысып, қасиеттерін өзгертуі ойландырып келді. Мысалы, неге су қатып, мұзға айналады, ал қыздырғанда буға айналып кетеді? Сол сияқты металдар да қыздырғанда балқиды да, суытқанда қатаяды. Ал олар булана ала ма? Заттың құрылысы туралы теория осындай сұрақтарға нақты жауаптар бере алады.
Алғаш рет денелердің барлығы да өте кішкентай бөлшектерден тұрады деген идея ертедегі Эллада елінде қалыптасты. Оның негізін салушы - грек ғұламасы Демокрит(б.з.б. 460- 370). Ол кез келген денені ұсақтап бөле отырып, ең соңында бөлінбейтін бөлшек - атомды (көне грекше: ἄτομος - бөлінбейтін) алуға болады деді. Атомдар үздіксіз козғалады, әр түрлі денелердің атомдарының пішіні мен көлемдері де өр түрлі болады деп пайымдады.
Демокриттің идеясын Эпикур (б.з.б. 341-270) одан әрі дамытты. Ол да Демокрит сияқты атомдар өздерінің пішіні мен көлеміне және салмағына қарай әр түрлі болады деп қорытты. Заттың құрылысы туралы мұндай пайымдаулар эксперимент жүзінде дәлелденбеген, тек жорамалдар ғана еді. Сондықтан заттың атомдық құрылысы туралы ілім ұзақ уақыт қолдау таппады. Тіпті ұлы Аристотельдің өзі де Демокриттің көзқарасымен келіспеді. Ол денені шексіз ұсақтап беле беруге болады деді. АлЕуропада қайта өрлеу дәуірінің өзінде де (XVII ғ.) заттың атомдардан тұратыны туралы ілімді таратушыларды өлім жазасына кесетін болды. Соған қарамастан өзінің ғылыми көзқарасы үшін отқа өртенген Джордано Бруно (1548-1600) заттардың атомдардан тұратынын қорғаумен өтті. Қайта өрлеу дәуірінің соңына қарай заттың атомдық құрылысы туралы ілім толық жеңіске жетті. Оған көптеген ұлы ғалымдардың еңбектері мен ашқан жаңалықтары өсер етті.
Зат кұрылысының молекулалы-кинетикалық теориясының негізгі қағидаларын кейінірек М.В. Ломоносов былай қорытындылап берді: 1) Барлық заттар өте ұсақ бөлшектерден - молекулалар мен атомдардан (Ломоносовша «корпускулалардан») тұрады; 2) Молекулалар мен атомдар үздіксіз ретсіз қозғалыста болады; 3) Молекулалар мен атомдар өзара әрекеттеседі.
XIX ғасырдағы эксперименттік зерттеулер зат құрылысы туралы молекулалы-кинетикалық теорияның барлық қағидаларының орындалатынын көрсетті. Мысалы, 1827 жылы ағылшын ғалымы Р. Броун (1773-1858) эксперимент жүзінде молекулалардың үздіксіз әрі ретсіз козғалыста болатынын дәлелдеді. Ол өсімдіктердің сұйықтықтағы тозаңшаларын микроскопта бақылау барысында олардың үздіксіз және ретсіз қозғалыста болатынын көрді. Here өсімдік тозаңшалары тынық сұйықтықта ретсіз қозғалыста болады? Бұл сұрақтың жауабын молекулалы-кинетикалық теория береді.
Расында да, үнемі үздіксіз және ретсіз қозғалыста болатын сүйык молекулалары тозаңшаны жан-жағынан соққылайды. Олардың соққылауы үздіксіз және әр түрлі бағытта болатындықтан, тозаңшалар да үздіксіз әрі ретсіз қозғалысқа түседі. Ұсақ бөлшектердің (шаң-тозаңның, т. б.) ауа мен сұйықтықтардағы ретсіз әрі үздіксіз қозғалуы броундық қозғалыс деп аталады. Бөлшектердің броундық қозғалысы атомдар мен молекулалардың бейберекет үздіксіз қозғалысының салдары болып табылады.
Қазіргі кезде металдардағы молекулалар мен атомдарды үлкейтіп көрсететін электрондық микроскоптар мен иондық проекторлар бар.
Ғылыми теорияның мәні құбылысты түсіндірумен ғана шектелмейді. Ол және құбылыстарды болжап, заттардың жаңадан туатын сапалық қасиеттерін де алдын ала айтып беруге жәрдемдеседі. Шынында да, молекулалы-кинетикалық теорияға негіздеп қасиеттері мүлдем жаңа материалдарды қолдан жасап алу мүмкіндігі туды. Мысалы, табиғи алмастан (қырналған алмасты бриллиант дейді) кем түспейтін жасанды алмастар жасалды.
Алмас да, көмір де көміртегі атомдарынан тұрады. Бірақ көміртегі атомдарының орналасуына қарай кәдімгі жұмсақ көмір (графит) немесе әлемдегі ең қатты алмас алынады. Алмасты алу үшін қажетті қысым мен температураның шамасын алдын ала есептеуге болады. Жоғары температурада үлкен қысым түсіріп, графит атомдарын табиғи алмастағы сияқты орналастыра аламыз. Сөйтіп, өте жұмсак графиттен табиғаттағы ең қатты зат - алмас алынады. Алмастан бриллиант жасалады. Сондай-ақ алмас бұрғылау станоктарында, материалдарды өңдеуде және басқа да мақсаттар үшін қолданады.
Қымбат бағалы асыл тастарды да осындай жолдармен алуға болады. Ондай тастар кристалдар деп аталады. Теория олардың механикалық, оптикалык, электрлік, т. б. қасиеттерін алдын ала болжауға жәрдемдеседі.
Қазіргі уақытта қажетті қасиеттері бар қолдан алынатын жасанды материалдардың түрлері өте көп. Солардың қатарында металдар мен пластмассалардың қосылыстарын атауға болады. Ондай металпластмассалардың сапасы да ерекше. Мысалы, жай пластмассалар электр тогын өткізбейді, ал металпластмассалар токты жақсы өткізеді, оның үстіне металдарға қарағанда өте жеңіл әрі берік.
Міне, осылайша зат құрылысының молекулалы-кинетикалық теориясы экспериментте дәлелденіп, ғылым мен өндірісте және тұрмыста кең қолданыс тапты. Осы сияқты физиканың басқа да іргелі теориялары адамзаттың ақыл-ойының дамуына, өркениеттің өрістеуіне орасан зор үлес қосуда.
Молекулалы-кинетикалық теория-модельдер әдісін қолданатын теорияның мысалы. Модельдер әдісінің ерекшелігі - күрделі объектінің қасиеттерін экспериментті зерттеу нәтижесінде оның ішкі құрылымы және құрайтын бөліктерінің қасиеттері туралы гипотеза айту. Айтылған гипотеза зерттелген объектінің белгілі қасиеттерін түсіндіру керек және жаңа, бұрын белгісіз қасиеттерді немесе зандылықтарды болжау керек. Егер бұл болжаулар тәжірибеде расталса, онда гипотеза теорияның негізі болады. Физикалық объектінің немесе құбылыстың кез келген моделі - олардың қарапайымдалған, идеалданған суреттемесі.
Не нашли, что искали? Воспользуйтесь поиском: