
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Зависимость химических свойств элементов от строения их атомов
Согласно теории строения атома в основе химических реакций лежат процессы перестройки электронных оболочек атома – электронные взаимодействия. В химических реакциях участвуют главным образом электроны внешних слоев (валентные электроны). Обычно это одиночные (непарные, неспаренные) электроны.
Максимально заполненные орбитали наиболее устойчивы. Электронные слои, орбитали которых заполнены максимально, называются завершенными. Внешний электронный слой является завершенным, если имеет электронную конфигурацию s2p6 (восемь электронов), кроме гелия.
Атомы инертных элементов (Не, Ne, Аr, Кr, Хе, Rn) имеют завершенные внешние электронные слои и поэтому с большим трудом вступают в химические реакции. Атомы всех других элементов имеют незавершенные внешние электронные слои.
У атомов металлов во внешнем слое, как правило, содержится меньше четырех электронов, и они слабо связаны с атомом. Атомы металлов, вступая в химическую реакцию, теряют валентные электроны. Как известно, активность металлов различна. Например, натрий и калий - более активные металлы, чем золото и платина. Для сравнения активности металлов обычно используют специальную величину - энергию ионизации I.
Энергия ионизации - это количество энергии, необходимое для отрыва наиболее слабо связанного электрона от атома.
Энергию ионизации выражают в электрон-вольтах (эВ). Значения энергий ионизации более активных металлов меньше, чем менее активных. Щелочные металлы имеют самые низкие значения энергий ионизации
У атомов неметаллов во внешнем электронном слое содержится четыре и больше электронов, которые прочно связаны с атомом. Атомы неметаллов, вступая в химическую реакцию, обычно присоединяют электроны. Для сравнения неметаллических свойств используют специальную величину – сродство к электрону Е.
Сродство к электрону - это количество энергии, которое выделяется при присоединении одного электрона к нейтральному атому.
Сродство к электрону также выражают в электрон-вольтах (эВ). Наибольшие значения сродства к электрону у элементов главной подгруппы седьмой группы (F, C1, Вr, I), т.е. у типичных неметаллов.
С увеличением заряда ядра атомов у элементов одного периода уменьшается радиус атома, а количество внешних электронов увеличивается. Вследствие этого притяжение внешних электронов к ядру усиливается, энергия ионизации и сродство к электрону увеличиваются. Поэтому к концу периода металлические свойства элементов ослабляются, а неметаллические усиливаются.
В больших периодах металлические свойства ослабляются, а неметаллические усиливаются более медленно, чем в малых периодах. Это объясняется тем, что большие периоды содержат переходные элементы. На внешнем слое атомов переходных элементов находятся два s -электрона, а заполняются предпоследний слой у d- элементов и третий с конца у f- элементов.
В главных подгруппах с увеличением порядкового номера элемента (то есть сверху вниз) металлические свойства элементов усиливаются, а неметаллические ослабляются. Количественные изменения приводят к качественным. Отсюда следует, что самый активный металл - франций, самый активный неметалл - фтор. Деление элементов на металлы и неметаллы относительно. Как известно, существуют элементы с амфотерными свойствами.
Число электронов во внешнем слое атомов изменяется периодически с возрастанием заряда ядер атомов. Поэтому и свойства химических элементов изменяются периодически.
В настоящее время периодический закон формулируется так:
Свойства химических элементов, а также формы и свойства их соединений, находятся в периодической зависимости от величины заряда их атомных ядер или порядкового номера элемента в периодической системе.
Химическая связь.
Электронная теория строения атомов объясняет, как атомы соединяются в молекулы, т.е. природу и механизм образования химической связи.
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга.
Частицы, которые принимают участие в образовании химических связей, могут быть атомами, молекулами или ионами. В основе теории химической связи лежат представления об электронных взаимодействиях. Наиболее прочными группировками электронов являются завершенные внешние электронные слои атомов инертных элементов. Незавершенные внешние электронные слои всех остальных элементов являются неустойчивыми группировками электронов. При соединении атомов с незавершенными внешними электронными слоями происходит перестройка их электронных оболочек: непарные электроны различных атомов образуют общие электронные пары.
Основными типами химической связи являются ковалентная, ионная, металлическая и водородная.
Ковалентная связь
Рассмотрим образование молекулы водорода Н2 из атомов. Электронная конфигурация атома водорода Is1, т. е. на внешнем электронном слое (он единственный) находится один непарный электрон. При образовании молекулы водорода из двух атомов, имеющих непарные s-электроны с антипараллельными спинами, происходит перекрывание s-орбиталей и образуется общая электронная пара (рис. 4а).

Рис. 4 Перекрывание: а - s-орбиталей; 6- s- и р-орбиталей; в - р-орбиталей
Схематически это можно изобразить с помощью электронных формул:
Н *·+ * Н ® Н: Н
Общая электронная пара одинаково принадлежит обоим атомам, каждый атом получает устойчивую оболочку из двух электронов. Наибольшая электронная плотность общего электронного облака проявляется в области между ядрами. Молекула водорода образуется за счет взаимодействия общей электронной пары с ядрами обоих атомов.
Связь атомов с помощью общих электронных пар называется ковалентной.
В молекулах фтора F2, хлора С12, кислорода О2, азота N2 связь между атомами ковалентная. Она образуется в молекулах фтора и хлора с помощью общей электронной пары (рис. 4в), в молекуле азота — с помощью трех общих электронных пар. Схематически это можно изобразить так:


Во всех этих случаях каждый атом образует завершенный устойчивый внешний электронный слой из восьми электронов.
В молекулах, которые состоят из разных элементов, связь тоже может быть ковалентной. Рассмотрим образование молекулы хлороводорода. Электронные конфигурации атомов водорода и хлора
H 1s1; Cl 1s2 2s2 2p6 3s2 3p5
показывают, что внешние электронные слои этих атомов имеют по одному непарному электрону. При сближении орбитали этих электронов перекрываются, образуя общую электронную пару (рис. 4б).
Ковалентная связь может образоваться между двумя атомами, из которых один имеет пару электронов, а другой — свободную орбиталь. Например, при взаимодействии аммиака NH3 и хлороводорода НCl пара s-электронов атома азота, которые не участвуют в образовании связей в молекуле аммиака {неподеленная пара электронов) становится общей для водорода и азота, получается ион аммония 

Такой механизм образования ковалентной связи называется донорно-акцепторным. В нашем примере донором электронной пары является атом азота, а акцептором — ион водорода (он имеет свободную орбиталь). Донорно-акцепторный механизм образования ковалентной связи наблюдается в комплексных соединениях ([Ag(NH3)2]0H, K4[Fe(CN)6]).
Электроны, которые участвуют в образовании химических связей, называются валентными. У элементов главных подгрупп валентные электроны расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп (за исключением лантаноидов и актиноидов) валентные электроны расположены на s-орбиталях внешнего слоя и на d-орбиталях предпоследнего электронного слоя. Валентными электронами могут быть не только непарные электроны атома в нормальном (невозбужденном) состоянии, но и парные. Например, в нормальном состоянии атом углерода имеет два непарных электрона.
С 2s22p2
Однако в большинстве своих соединений атом углерода образует четыре ковалентных связи (СН4, СС14, СН3ОН и т. д.). Это становится возможным потому, что при поглощении энергии (420 кДж/моль) у атома углерода один 2s-электрон переходит на 2p-орбиталь:
C 2s12p3
Такой атом углерода называется возбужденным. Он имеет четыре непарных электрона и может образовать четыре ковалентных связи.
Если общие электронные пары обозначать чертой, то электронная формула превращается в структурную:
 : :
| 
| 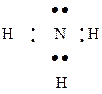
| 
|
| H - Cl | H – O - H | H –  - H - H
| H -  -:H -:H
|
Электронные и структурные формулы показывают последовательность соединения атомов в молекуле. Например, в молекуле аммиака атомы водорода соединяются с атомами азота, но между собой не соединяются.
Вещества с ковалентными связями могут быть твердыми (парафин, лед), жидкими (вода, спирт), газообразными (кислород, азот, аммиак) при обычных условиях.
Структурные формулы не отражают пространственного расположения атомов в молекуле. Изобразить его можно с помощью модели (рис. 5),

Рис. Модели молекул H2, H2O, NH3
Не нашли, что искали? Воспользуйтесь поиском: