
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Характеристики ковалентной связи
Ковалентная связь характеризуется направленностью в пространстве, полярностью, кратностью, энергией и длиной.
Как мы знаем, электронные орбитали (кроме s-орбиталей) имеют пространственную направленность. Ковалентная связь, которая является результатом электронно-ядерных взаимодействий, располагается в определенном направлении по отношению к ядрам этих атомов. Если электронные облака перекрываются в направлении прямой, которая соединяет ядра атомов (т. е. по оси связи), такая ковалентная связь называется s-связью (сигма-связью). Например, в молекулах Н2, Cl2, HC1 атомы соединяются ковалентной s-связью. Ковалентные сигма-связи образуются при перекрывании орбиталей: s — s (как в Н2): s — р (как в НС1), р — р (как в С12).
При перекрывании p-орбиталей, направленных перпендикулярно оси связи, образуются две области перекрывания по обе стороны оси связи. Такая ковалентная связь называется p-связью (пи-связью) (рис. 6). Например, в молекуле азота атомы связаны одной s-связью и двумя p-связями (рис. 7).
 Рис. 6. Схематическое изображение p-связи
Рис. 6. Схематическое изображение p-связи
 Рис. 7. Схематическое изображение s- и p-связей в молекуле азота
Рис. 7. Схематическое изображение s- и p-связей в молекуле азота
Направленность ковалентной связи определяет пространственную структуру молекул, т. е. их форму. Молекула хлороводорода имеет линейную форму: она образована с помощью одной s-связи (s — р-орбитали). Молекула воды имеет угловое строение: она образуется за счет перекрытия s-орбиталей двух атомов водорода с двумя взаимно перпендикулярными р-орбиталями атома кислорода (рис. 8). Следовательно, угол между s-связями в молекуле воды должен быть равен 90°. В действительности угол равен 104,5°, что объясняется явлением гибридизации. Молекула аммиака имеет форму правильной пирамиды, молекула метана — форму тетраэдра.

Рис. 8. Строение молекулы воды
Полярность связи определяется асимметрией в распределении общего электронного облака вдоль оси связи.
Если общие электронные пары располагаются симметрично относительно обоих ядер, то такая ковалентная связь называется неполярной.
В молекулах простых веществ — водорода Н2, кислорода О2, азота N2, хлора С12, фтора F2 атомы соединяются неполярной ковалентной связью.
Если общие электронные пары смещаются к одному из атомов (располагаются несимметрично относительно ядер различных атомов), то такая ковалентная связь называется полярной.
Связь в молекулах воды Н2О, аммиака NH3, хлороводорода НС1— полярная.
Кратность ковалентной связи определяется числом общих электронных пар, которые связывают атомы.
Связь между двумя атомами при помощи одной пары электронов называется простой (связи Н — С1,С — Н,Н — О и т. д.). Связь между двумя атомами при помощи двух электронных пар называется двойной. Связь между двумя атомами при помощи трех электронных пар называется тройной.
Например, двойная связь наблюдается между атомами углерода в этилене Н2С = СН2, тройная связь наблюдается в молекулах азота N 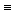 N, ацетилена Н — С
N, ацетилена Н — С 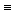 С — Н.
С — Н.
Длина связи — это равновесное расстояние между ядрами атомов. Длину связи выражают в нанометрах (нм). Чем меньше длина связи, тем прочнее химическая связь. Мерой прочности связи является ее энергия.
Энергия связи равна работе, которую необходимо затратить на разрыв связи. Выражают энергию связи в килоджоулях на моль (кДж/моль); например, в молекуле водорода энергия связи равна 435 кДж/моль. Энергия связи увеличивается с уменьшением длины связи (табл. 10).
Таблица 10. Вид, длина и энергия связи в молекулах некоторых веществ
| Молекула | Вид связи | Длина связи, нм | Энергия связи, кДж/моль |
| H2 С12 HF | sx(s—s) sx (px-px) sx (s—p) | 0,074 0,20 0,092 |
Энергия связи увеличивается с увеличением кратности связи (табл. 11).
Таблица 11. Длина и энергия связи между атомами азота и между атомами углерода
| Связь | Длина связи, нм | Энергия связи, кДж/моль |
| N - N | 0,140 | 164,2 |
| N = N | 0,120 | 420,5 |
N 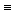 N N
| 0,109 | 945,6 |
| С - С | 0,154 | 347,7 |
| С = С | 0,134 | 606,7 |
C 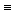 C C
| 0,120 | 831,4 |
Процесс образования связи протекает с выделением энергии (экзотермический процесс), а процесс разрыва связи — с поглощением энергии (эндотермический процесс).
Полярность молекул
Полярность молекул зависит от полярности отдельных связей и от их расположения в молекуле (т. е. от строения молекул).
Молекулы простых веществ (Н2, F2, N2 и др.), образованные неполярными ковалентными связями, неполярны.
Молекулы сложных веществ могут быть и неполярными и полярными. Примеры веществ с неполярными молекулами: диоксид углерода СО2, метан СН4, бензол С6Н6, глюкоза С6Н12О6, диметиловый эфир С2Н6О и др. Примеры веществ с полярными молекулами: диоксид серы SO2, вода Н2О, аммиак NH3, этиловый спирт С2Н5ОН и др.
В неполярных молекулах «центр тяжести» электронного облака совпадает с «центром тяжести» положительного заряда ядер. В полярных молекулах «центр тяжести» электронного облака не совпадает с «центром тяжести» положительного заряда.
Например, в молекуле хлороводорода НС1 электронная плотность около ядра хлора выше, чем около ядра водорода, т. е. атом хлора имеет отрицательный заряд q = - 0,18, а атом водорода положительный заряд q -= + 0,18. Заряды (q) атомов в молекуле называют .эффективными. Поэтому полярные молекулы можно рассматривать как электрические диполи, в которых заряды, разные по знаку, но одинаковые по величине, расположены на определенном расстоянии друг от друга. Мерой полярности молекул является электрический момент диполя.
Электрический момент диполя — это произведение эффективного заряда на расстояние между центрами положительного и отрицательного зарядов в молекуле. Электрический момент диполя в молекуле зависит от ее структуры. Наличие или отсутствие электрического момента диполя позволяет судить о геометрическом строении молекулы. Например, молекула СО2 неполярна, а молекула SO2 обладает электрическим моментом диполя. Отсюда следует, что молекула СО2 имеет линейное строение, а молекула SO2 — угловое.
Свойства веществ зависят от полярности молекул. Вещества, молекулы которых полярны, имеют температуры кипения и плавления выше, чем вещества, молекулы которых неполярны. Это объясняется взаимным притяжением полярных молекул.
Не нашли, что искали? Воспользуйтесь поиском: