
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тема: Агрегатний стан речовин.
Мета: Ознайомитися з основними агрегатними станами речовин.
План заняття:
1.Газовий стан речовин. Ідеальний газ.
2.Молекулярно-кінетична теорія газів. Газова постійна.
3.Основні закони ідеальних газів.
4.Рідкий стан речовини. Властивості рідини.
5.В’язкість.
6.Твердий стан речовини.
7.Плазма.
8.Типи кристалічних граток.
Майже всі відомі речовини в залежності від умов можуть знаходитись в газоподібному, рідкому або твердому стані. Це агрегатні стани речовини. Агрегатні стани не впливають на хімічні властивості та склад однієї й тієї ж речовини, однак фізичні властивості її не однакові. Наприклад, вода – лід, рідка вода та пара – мають однаковий склад та хімічні властивості, однак фізичні властивості її (щільність, тощо) не однакові. Різниця у фізичних властивостях обумовлена тим, що частки в газоподібних, рідких та твердих речовинах розташовані на неоднакових відстанях одна від одної, завдяки чому сили притяжіння між молекулами проявляються в неоднаковому ступеню. В газах молекули знаходяться на відносно великій відстані одна від одної, сили притяжіння між ними невеликі. Гази володіють малою щільністю, не мають ні власної форми, ні власного об’єму та займають будь-який наданий ним об’єм. При підвищенні тиску гази легко змінюють свій об’єм.
В рідинах молекули більш наближені, сили міжмолекулярного притяжіння при цьому сильно збільшуються. Щільність рідин у багато разів перевищує щільність газів. Рідини володіють власним об’ємом, бо збільшені сили притяжіння не дозволяють молекулам віддалятися одна від одної на великі відстані. Однак молекули в рідинах ще не закріплені в певних точках простору і знаходяться, як і в газах, в хаотично-поступовому русі. Тому рідини не мають власної форми та приймають форму тієї судини, в яку вони налиті. При підвищенні тиску рідини незначно змінюють свій об’єм. Цьому заважають виникаючі при зближенні молекул сили електростатичного відштовхування.
В твердих тілах частки вже настільки наближені, що їх збільшені сили притяжіння врівноважуються силами відштовхування. Внаслідок цього частки геометрично правильно розташовуються в певних точках простору, утворюючи просторову кристалічну решітку. Частки твердого тіла позбавляються властивості поступового руху та випробовують лише коливальні рухи, знаходячись в вузлах кристалічної решітки. Тверді тіла володіють як власним об’ємом, так і власною формою.
Дослід показує, що поступово змінюючи зовнішні умови, можна здійснити перехід із одного агрегатного стану до іншого. На агрегатних станах речовини можна наочно дослідити прояв одного з найважливіших законів природи – закону переходу кількісних змін у якісні.
Із зміною температури та тиску поступово змінюються відстані між частками у речовині (кількісний бік) і на певному етапі стрибком з’являється нова якість, тобто новий агрегатний стан.
Порівняно нещодавно вчені стали ретельно вивчати четвертий стан речовини - плазмовий, або плазму.
Гази розповсюджені в природі та знаходять широке застосування в техніці. Їх використовують в якості палива, теплоносіїв, сировини для хімічної промисловості, робочого тіла для виконання механічної роботи (газові турбіни); гази є фізичним середовищем для здійснення газового розряду в трубках, їх використовують при зварюванні та різкі металів, при газовій хіміко-термічній обробці металевих поверхнею, в деяких біохімічних процесах, тощо.
В техніці знаходять застосування понад 30 різних газів. Особливо часто використовується природний газ, який є майже чистим метаном, а також повітря, що представляє суміш газів (здебільше азоту та кисню). В останні роки з метою інтенсифікації багатьох окислювальних процесів в металургійній та хімічні промисловості з успіхом застосовується газоподібний кисень.
В фізиці, фізичній хімії та термодинаміці часто застосовують терміни «ідеальний» та «реальний» гази. Ідеальним називається газ, що знаходиться в таких умовах, при яких можна нехтувати силами взаємодії між молекулами та власним об’ємом молекул, який надзвичайно малий порівняно із загальним об’ємом газу.
В газах, які реально існують в природі (в реальних газах), порівняно невеликі за величиною сили міжмолекулярного притяжіння (сили зчеплення) та відштовхування виявляються більшою чи меншою мірою в залежності від температури та тиску. Молекули реальних газів володіють (хоча і дуже малим) власним об’ємом, який поряд з міжмолекулярними силами зчеплення та відштовхування, що проявляються, необхідно враховувати при різного роду розрахунках.
З підвищенням температури гази розширюються, відстань між молекулами збільшується, а міжмолекулярні сили взаємодії слабшають. В умовах високих температур та низького тиску можна не брати до уваги нікчемно малі величини сил притяжіння та відштовхування і не враховувати вельми малий (порівняно із загальним об’ємом газу) власний об’єм молекул. Подібний стан реального газу наближається до ідеального газу. Таким чином, ідеальний газ є граничним станом будь-якої речовини (твердої, рідкої та газоподібної) при достатньо високій температурі та низькому тиску.
Фізичний стан газу визначається трьома параметрами: тиском P, об’ємом V та температурою T. Ці величини пов’язані рівнянням стану ідеального газу. Приватна форма цього рівняння була надана французьким вченим Б.Клапейроном (1834):
РV=RT,
де p – тиск, v – об’єм 1 кг газу, Т – температура за абсолютною шкалою, r – індивідуальна для кожного газу постійна (постійна Клапейрона).Більш зручну форму рівняння стану ідеального газу запропонував Д. І. Менделєєв (1874):
РV = nRT,
де v – об’єм n молей газу при тиску p та абсолютній температурі T, R – молярна газова постійна (постійна Менделєєва), відноситься до 1 кіломолю (молю) газу та однакова у всіх газів. R = 8,314 Дж/ (моль*К).
Абсолютною називається температура, яка виражена в градусах термодинамічної температурної шкали. Нуль цієї шкали знаходиться на 273,15о нижче нуля Міжнародної практичної шкали та називається абсолютним нулем. Температури з обома шкалами можуть бути виражені відповідно в градусах Кельвіна (Т, К) та в градусах Цельсія (t, оС). В розрахунках користуються простим співвідношенням:
Т = t + 273,15.
Число кіломолей газу можна вирахувати, знаючи його масу m та молярну масу M:
n = 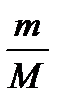
Отже, розгорнута формула рівняння стану ідеального газу має вигляд:
РV = 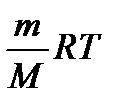
Рівняння стану ідеального газу широко застосовується для вирахування параметрів стану газів (p, v, або T), а також при дослідному визначення молярних мас газоподібних (пароподібних) речовин на основі виміряння m, p; v та T газу (або пари):
M = 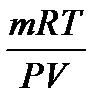
Закони ідеальних газів надзвичайно прості. Спочатку вони були встановлені дослідним шляхом. Теоретичне тлумачення і обґрунтування цих законів було надано пізніше на підставі молекулярно-кінетичної теорії.
В основі молекулярно-кінетичної теорії газів є наступні припущення:
- молекули газу представляють собою маленькі пружні кульки, які постійно знаходяться в стані хаотичного поступового руху (тепловий рух);
- об’єм самих молекул надзвичайно малий порівняно із загальним об’ємом газу, тому молекули розглядають як матеріальні точки, які мають масу m;
- від зіткнення до зіткнення молекулі газу один на одного не діють і рухаються прямолінійно;
- при даній температурі все молекули рухаються з деякою постійною (середньою) швидкістю. При підвищенні температури середня швидкість молекул зростає;
- зіткнення молекул одна з одною підкоряється закону зіткнення пружних куль, а саме після зіткнення (при постійній температурі) змінюється напрям руху молекул, а величина їх швидкості залишається колишньою. Отже, при пружних зіткненнях молекул обмін енергією між ними не відбувається.
В дійсності рух та зіткнення молекул газу одна з одною і зі стінками судини протікає набагато складніше. Внаслідок того, що зіткнення часток не цілком пружні, окремі молекули в різні моменти часу мають найрізноманітніші швидкості як за напрямом, так і за величиною. З цієї причини неможливо описати рух окремої молекули. Однак при великій кількості молекул в даному об’ємі газу та безладному їх русі стає можливим застосування законів теорії імовірності.
В молекулярно-кінетичній теорії газів в розрахунках часто використовуються величини середньої арифметичної та середньої квадратичної швидкостей.
Середня арифметична швидкість виражається співвідношенням:
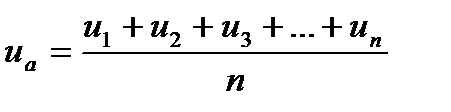
Середня квадратична швидкість
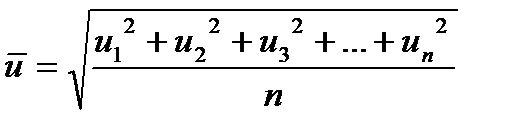 ,
,
де - u1, u2, u3, …, un - швидкості руху окремих молекул;
n - загальна кількість молекул.
Ідеальні гази точно підпорядковуються законам Бойня - Маріотта(1662), Шарля (1787), Гей-Люссака (1802) та Авогадро (1811).
Закон Бойля – Маріотта. Об’єм даної маси газу при постійній температурі змінюється зворотно-пропорційно тиску, під яким газ знаходиться
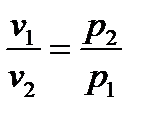 , або p1v1 = p2v2
, або p1v1 = p2v2
Звідси витікає, що таке рівняння можна написати і для інших значень p та v:
pv = const,
тобто добуток тиску на об’єм даної маси газу є величина постійна при постійній температурі. Константа в цьому рівнянні залежить від природи газу, його кількості і температури, але не залежить ані від тиску, ані від об’єму.
Закон Бойля – Маріотта витікає з основного рівняння молекулярно-кінетичної теорії:
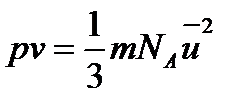 ,
,
оскільки m - маса молекули газу – величина постійна;
N - число молекул в даному об’ємі, також постійно;
 - середня квадратична швидкість молекул – постійна величина при постійній температурі.
- середня квадратична швидкість молекул – постійна величина при постійній температурі.
Графічно закон Бойля – Маріотта в системі координат p – v відображується у вигляді гіперболи – ізотерми.
Із закону Бойля-Маріотта витікає наслідок: концентрація та щільність газу зворотно пропорційні тиску:
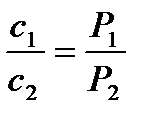 ;
; 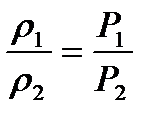 .
.
Закон Гей-Люссака: при нагріванні даної маси газу на 1 градус при постійному тиску об’єм його збільшується на1/273,15 частину того об’єму, який мав би газ при 00С. Величина 1/273,15 називається коефіцієнтом термічного розширення і позначається a. Аналітичним вираженням цього закону Гей-Люссака є:
 ;
; 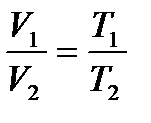
Закон Шарля: при підвищенні температури на 1 градус при постійному об’ємі тиск даної маси газу зросте на 1/273,15 тиску при 00С. Цю величину називають термічним коефіцієнтом пружності газу. Аналітичним вираженням цього закону є:
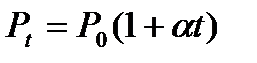 ; або
; або 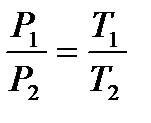 ,
,
тобто для даної маси газу тиск пр. постійному об’ємі або об’єм при постійному тиску прямо пропорційні абсолютній температурі.
Наслідок з цих законів: концентрація і щільність газу зворотно пропорційні абсолютній температурі:
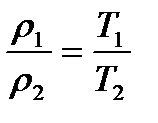 ;
; 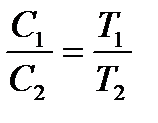 .
.
Закон Авогадро: в рівних об’ємах різних газів при однакових температур та тиску міститься однакова кількість молекул.
В 1 кіломолі це число становить NA=6,025*1026(число Авогадро).
Наслідок з цього закону: один кіломоль (моль) будь-якого газу при нормальних умовах замає об’єм 22,4 м3 (22,4 л).
При виведенні законів ідеальних газів не враховувались сили міжмолекулярного при тяжіння та об’єм самих молекул. Реальні гази не можуть точно відповідати законам ідеальних. Чим вища щільність газу та маса його часток, тим більшим стає відхилення. Поведінку реальних газів при середніх тисках характеризує рівняння стану, запропоновано голландським вченим Ван-дер-Ваальсом. В рівняння стану він ввів поправки: P¢(величина, що характеризує силу міжмолекулярного при тяжіння), та b (поправка на власний об’єм молекул). P¢ – це внутрішній тиск газу, він в рівнянні має знак плюс, P¢=a/V, а b – величина об’єму самих молекул, її необхідно відрахувати. В цілому рівняння Ван-дер-Ваальса має вигляд:
( )(V – b) = RT
)(V – b) = RT
Температура, вища за яку газ не може перейти в рідину ні при яких умовах, називається критичною. Отримані низьких температур і скраплення ґрунтується на ефекті Джоуля – Томсона – при розширенні газу енергія. У випадку ідеальних газів цей ефект дорівнює 0.
В цих випадках використовується коефіцієнт стискальності: 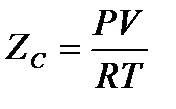 - коефіцієнт стискальності, для вирахування якого використовують такі величини:
- коефіцієнт стискальності, для вирахування якого використовують такі величини:
 - приведений тиск,
- приведений тиск, 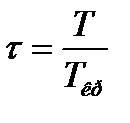 - приведена температура.
- приведена температура.
В техніці часто використовують газові суміші. В газових сумішах при невеликих тисках кожен газ веде себе незалежно від інших. Для них велике значення має поняття парціальних тисків.
Парціальним тиском називається той тиск, який окаже даний газ, що входить до складу суміші, коли він один буде займати об’єм всієї суміші. Коли газова суміш підпорядковується законам ідеальних газів, вона називається ідеальною газовою сумішшю. Реальні гази відхиляються від реальних тим сильніше, чим вища їх щільність
Основний закон газових сумішей – закон Дальтона: загальний тиск газової суміші, яка складається із газів, які хімічно не взаємодіють один з одним, дорівнює сумі парціальних тисків всіх газів, що входять в неї.
Рзаг=Р1+Р2+…+Рn
В суміші газів до кожного газу може бути застосовано рівняння стану:
В смеси газов к каждому газу может быть применено уравнение состояния:

де Vзаг – загальний об’єм суміші, ni- кількість молекул окремих газів в суміші. Підставивши це рівняння в рівняння стану, отримаємо: РзагVзаг = SnRT.
Є поняття і парціального об’єму.
Парціальний об’єм – це об’єм, який займав би кожний окремо взятий газ, що входить до складу ідеальної суміші, при заданих умовах. Сума парціальних об’ємів дорівнює загальному об’єму суміші:
Vзаг = V1+V2+…+Vn
Газову суміш характеризує також поняття об’ємного відсотку, який виражається числом кубічних метрів даного газу, взятих при температурі та тиску суміші, що містяться в 100 кг газової суміші:
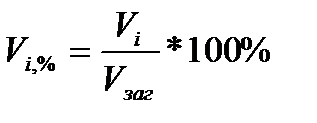 .
.
Відношення V1/Vзаг, V2/Vзаг називають об’ємною долею газу.
Ваговий відсоток даного газу – число кілограмів газу, що містяться в 100 кг газової суміші:
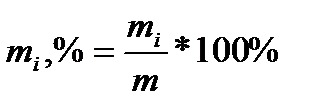
Співвідношення m1/m, m2/m… називається ваговою долею даного газу.
Кіломольною (мольною) долею називається відношення числа кіло молей (молей) даного газу до загального числа кіло молей газів, що складають газову суміш:
Киломольной (мольной) долей называется відношення числа киломолей (молей) данного газа к общему числу киломолей газов, составляющих газовую смесь:

де Ni – кіломольна (мольна) доля, n1, n2… - число кіло молей (молей) окремих газів, Sn – загальна сума кіло молей усіх газів в суміші. Сума мольних долів дорівнює одиниці. Кіломольна доля,збільшена в 100 разів, називається кіломольним (мольним) відсотком.
Парціальні тиски окремих газів в суміші виміряти не можна. Їх величину вираховують за законом Дальтона:
Парциальные давления отдельных газов в смеси измерить нельзя. Их величину вычисляют по закону Дальтона:
Рі = Ni * Рзаг.
Тобто парціальний тиск будь-якого газу газової суміші дорівнює мольній долі його в суміші, помноженої на загальний тиск суміші.
Не нашли, что искали? Воспользуйтесь поиском: