
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тема: Хімічна рівновага. зворотність хімічних реакцій. швидкість прямої та зворотної реакцій та закон дії ваг. принцип Ле-шател’є
Мета: Ознайомитися з хімічною рівновагою, вивчити зворотні та незворотні реакції і розібратися які фактори впливають на хімічну рівновагу.
План
1.Зворотність хімічних реакцій
2.Ознаки хімічної рівноваги
3. Константи хімічної рівноваги
4.Хімічна спорідненість речовин
5.Принцип Ле-Шател’е
6.Ізохора і ізобара хімічної реакції
Теоретично всі хімічні реакції зворотні, тобто вони можуть протікати як в прямому, так і в зворотному напрямках. Цю зворотність було доведено при пропусканні суміші газів – кисню та водню – через розпечену трубку. При цьому утворювався пар:
2Н2 + О2 ® 2 Н2О
При пропусканні водяного пару через цю ж трубку відбувається часткове розкладання води на водень та кисень:
2Н2О (пар) ® 2Н2 + О2
Отже, реакція між киснем та воднем зворотна:
2Н2 + О2 «2 Н2О
Реакції, що супроводжуються утворенням важкорозчинених осадів, є практично незворотними, так як при цьому швидкість зворотної реакції та концентрації вихідних речовин настільки малі, що не піддаються практичному визначенню.
Практично незворотними є також реакції, що проходять з утворенням газоподібних речовин.
Зворотні реакції ніколи не доходять до кінця, тобто до повного зникнення вихідних речовин і перетворення їх в продукти. Межею протікання зворотної реакції при заданих умовах є досягнення стану рівноваги. Справжня хімічна рівновага характеризується наступними ознаками:
1. В момент рівноваги швидкості прямої та зворотної реакцій рівні, а концентрації всіх речовин, що беруть участь в реакції, досягнувши певного значення, залишаються незмінними як завгодно довго при постійних зовнішніх умовах.
2. Хімічна рівновага рухлива. Навіть незначна зміна зовнішніх умов (температури, тиску, концентрації) призводить до порушенню та зсуву рівноваги в той чи інший бік. Через деякий час установлюється нова рівновага, яка відповідає зміні зовнішніх умов.
3. До одного й того ж стану рівноваги можна підійти з двох боків, здійснюючи процес як зліва направо, так і справа наліво. Наприклад, для реакції загального виду:
А + В «С + Д
можна взяти вихідні речовини і провести реакцію, прийшовши до стану рівноваги, а можна до стану рівноваги підійти, взявши за основу продукти та отримати вихідні речовини. Для одних і тих самих умов рівноважні концентрації одних і тих самих речовин будуть однаковими.
4. В момент досягнення рівноваги запас вільної енергії системи є мінімальним, а ентропія – максимальною.
Таким чином, сталість складу ще не є ознакою справжньої хімічної рівноваги.
КОНСТАНТА ХІМІЧНОЇ РІВНОВАГИ
Розглянемо реакцію
А + В «С + Д
В початковий момент часу концентрації А і В максимальні, у зв’язку з чим швидкість реакції також максимальна. З часом концентрації, а, отже, і швидкість будуть зменшуватись. В той же час швидкість зворотної реакції в початковий момент часу дорівнює 0. З часом же при накопиченні продуктів вона буде збільшуватись. Через деякий час швидкість прямої реакції стане дорівнювати швидкості зворотної. Наступає хімічна рівновага.
v пр= vзвор
k1CACB = k2CCCD Þ

відношення  називається константою хімічної рівноваги. Вона показує, у скільки разів константа швидкості прямої реакції k1 більша або менша за константу швидкості зворотної реакції k2. Вона залежить від:
називається константою хімічної рівноваги. Вона показує, у скільки разів константа швидкості прямої реакції k1 більша або менша за константу швидкості зворотної реакції k2. Вона залежить від:
- природи реагуючих речовин;
- температури
і не залежить ні від концентрації реагуючих речовин, ні від інших факторів.
Таким чином, закон дії ваг для моменту хімічної рівноваги формулюється так: для моменту хімічної рівноваги відношення добуток мольних рівноважних концентрацій до добутку мольних концентрацій вихідних речовин є величина постійна при постійній температурі.
Як би не змінювались концентрації, в момент рівноваги їх співвідношення завжди дорівнює К.
Константи рівноваги реакцій визначаються дослідним шляхом методом визначення складу рівноважних сумішей при заданих умовах.
У газових реакцій при обчисленні констант рівноваги користаються величинами парціальних тисків газів в рівноважній газовій суміші:

Між константами рівноваги, вираженими через концентрації і парціальні тиски, існує зв'язок:

де Sn – алгебраїчна сума молей газоподібних речовин, які беруть участь в реакції.
ХІМІЧНА СПОРІДНЕНІСТЬ РЕЧОВИН. РІВНЯННЯ ІЗОТЕРМИ ХІМІЧНОЇ РЕАКЦІЇ
Хімічна спорідненість – це здатність речовин вступати в хімічну взаємодію одне з одним. Вона залежить від:
1. природи реагуючих речовин;
2. концентрації або тиску;
3. температури.
Хімічну спорідненість безпосередньо вимірити не можна. Вважають, що хімічна спорідненість характеризує зміна термодинамічних потенціалів DF і DG.
Для термодинамічно зворотної реакції загального виду
n1A + n2D «n3C + n4D
зміна термодинамічних потенціалів і хімічна спорідненість при постійній температурі обчислюють, використовуючи співвідношення, виведене Вант-Гоффом і називане рівнянням ізотерми хімічної реакції:
DFт = RТ(ln  - lnКС)
- lnКС)
DG= RТ(ln  - lnКР)
- lnКР)
де КС і КР- константи рівноваги при температурі Т, СА, СВ, СС, СД- нерівноважні або вільні (тобто довільно задані) концентрації реагуючих речовин, РА, РВ, РС, РД – нерівноважні (вільні) парціальні тиски, R – універсальна газова постійна.
Знак (-) перед DF і DG означає можливість мимовільного протікання при заданих умовах прямих реакцій, а знак (+) – зворотних.
ПРИНЦИП ЛЕ-ШАТЕЛ ’Є
Зворотні реакції самі по собі не можуть протікати до кінця, даючи 100% вихід продукту. В багатьох випадках рівновага наступає швидко, на самому початку реакції, коли вихідних речовин вступає в реакцію зовсім мало, а вихід продукту незначний. Використовуючи рухливість рівноважних систем, впливаючи різними факторами, можна домогтися зсуву рівноваги в потрібному напрямку. Зсуву можна досягнути зміною концентрації, тиску, температури. Каталізатори не зміщають рівновагу, а лише прискорюють його наступ. Для визначення зсуву рівноваги існує ПРИНЦИП ЛЕ-ШАТЕЛ’Є: коли на систему, що знаходиться в стійкій рівновазі, впливати ззовні, змінюючи температуру, тиск, або концентрації реагуючих речовин, то рівновага зміщається в тому напрямку, при якому ефект зробленого впливу зменшується.
Виходячи з цього принципу, для здійснення зрушення рівноваги вправо необхідно:
- збільшити концентрації (парціальні тиски) вихідних речовин;
- зменшити концентрації (парціальні тиски) одного з продуктів, зв'язуючи його, наприклад, хімічно.
Навпаки, щоб здійснити зрушення рівноваги уліво, необхідно:
- збільшити концентрації (парціальні тиски) продуктів;
- зменшити концентрацію одного з вихідних речовин.
Всі екзотермічні реакції невигідно проводити при нагріванні, так як при цьому зсув рівноваги буде відбуватися в бік посилення зворотної (ендотермічної) реакції. Такі процеси необхідно здійснювати при безупинному відводі теплоти, що виділяється при реакції. Проведенню ендотермічних процесів сприяє підведення теплоти (зсув в прямому напрямку).
Зміна тиску призводить до зсуву рівноваги тільки в реакціях між газами, що супроводжуються зміною кількості молей газів. Керуючись принципом Ле-Шател’є, можна сказати, що з підвищенням тиску будуть більш інтенсивно протікати реакції, супроводжуються зменшенням кількості молей газів, зменшення ж тиску призведе до зменшення кількості молей і загальної кількості молекул в одиниці об’єму і рівновага буде зрушуватися в бік реакцій, в яких бере участь більша кількість молей газів.
Однак принцип Ле-Шател’є дає уявлення тільки про якісний зсув рівноваги. Кількісно ж цей процес характеризується рівняннями ізохори та ізобари хімічної реакції:
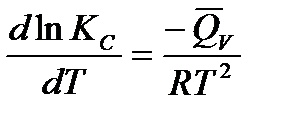 - рівняння ізохори;
- рівняння ізохори;
 - рівняння ізобари.
- рівняння ізобари.
РІВНОВАГА В ГЕТЕРОГЕННИХ СИСТЕМАХ
Вважається, що тверді речовини, хоча і в незначному ступені, здатні переходити в пар. Причому для даної температури тиск насичених парів – величина постійна. Для кожної заданої температури існує лише один, суворо визначений парціальний тиск, який називається тиском дисоціації, або пружністю дисоціації.
Для обчислення постійної рівноваги гетерогенних реакцій необхідно враховувати тільки парціальні тиски газоподібних речовин, взявши їх в ступені, який дорівнює стехіометричному коефіцієнту, який стоїть перед даною речовиною в рівнянні хімічної реакції:
КР = 
Температура, при якій пружність дисоціації газу стає рівною величині зовнішнього (нормального) тиску, називається температурою розпаду. Нижче за неї розпад речовин майже не спостерігається.
МЕТОДИ УПРАВЛІННЯ ХІМІЧНИМИ ПРОЦЕСАМИ
Будь-яка речовина в процесі виробництва перетерплює ту чи іншу зміну. Вона може бути:
- фізичною, коли речовина змінює тільки фізичні параметри;
- хімічною, коли речовина змінює хімічні властивості і склад.
Жоден процес не може проходити без технологічних розрахунків. При цьому перед їх здійсненням необхідно вивчити хіміко-технологічні процеси, що лежать в основі процесу. Внаслідок розрахунків установлюються найбільш сприятливі (оптимальні) умови ведення процесів.
Умілим, науково обґрунтованим підбором факторів, що впливають на проведення хімічних реакцій, здійснюють виробничі процеси.
Питання для самоперевірки
1. Які реакції називаються зворотними?
2. Які ознаки справжньої хімічної рівноваги?
3. Що називається константою хімічної рівноваги?
4. Який зв’язок між константами рівноваги КС та КР?
5. Що називається хімічною спорідненістю речовин?
6. Сформулюйте принцип Ле-Шател’є.
7. У яких випадках використовують рівняння ізохори та ізобари хімічної реакції?
Тема: Електрохімія.
Мета: Ознайомитися з задачами електрохімії. Вивчити явище електролізу вивчити гальванічні елементи.
План
1.Поняття про електрохімію як науку
2.Провідники першого і другого роду
3.Питома електропровідність
4.Еквівалентна електропровідність
5.Швидкість і рухливість іонів. Закон Кольрауша
6.Електроліз. Закони Фарадея
7.Поняття про гальванічні елементи.
8.Пристрій і робота елементу Якобі – Даніеля
9.Визначення ЕДС гальванічних елементів
10.Концентраційні ланцюги
ЕЛЕКТРОХІМІЯ – розділ фізичної хімії, що займається вивченням закономірностей взаємних перетворень електричної і хімічної енергії. Електрохімія розглядає електричну провідність розчинів, роботу гальванічних елементів, процеси електролізу і має велике теоретичне і практичне значення. У розвиток електрохімії великий вклад внесли Вольт, Фарадей, Нернст, Арреніус, Оствальд і багато інших всесвітньо відомих учених.
По електричній провідності струму всі речовини діляться на три групи: провідники, напівпровідники і діелектрики (ізолятори). Розрізняють провідники першого і другого роду.
До провідників першого роду відносяться всі метали, їх сплави, вугілля і графіт. Електрична провідність провідників першого роду не супроводжується перенесенням речовини і не спричиняє за собою хімічного перетворення матеріалу, з якого зроблений провідник. При підвищенні температури електрична провідність металів зменшується, а опір зростає, оскільки впорядкованому руху електронів заважає тепловий рух часток, що посилюється, в кристалічній решітці.
До провідників другого роду відносяться розчини і розплави електролітів. З підвищенням температури їх електрична провідність збільшується, оскільки при цьому зменшується в'язкість середовища, в якому переміщаються іони і збільшується швидкість пересування іонів до електродів. Провідники другого роду володіють набагато меншою провідністю в порівнянні з провідниками першого роду. Електрична провідність провідників першого роду обумовлена наявністю в їх кристалічних решітках вільних або слабо зв'язаних електронів – електронний характер провідності. У провідників другого роду перенесення електрики здійснюється іонами електроліту, внаслідок чого спостерігається хімічне розкладання речовин – іонний характер провідності.
Електричною провідністю називається здатність речовин пропускати електричний струм під дією електричної напруги. Це величина, зворотна опору. За одиницю її прийнятий Сименс:
R = 
де l – довжина провідника, S – площа поперечного перетину r - питомий опір, тобто опір стовпчика речовини довжиною 1 м-коду при поперечному перетині 1 м2.
Величина, зворотна питомому опору, називається питомою електричною провідністю х. Вимірюється вона в См/м:
х = 
У провідників другого роду питомою електричною провідністю називається електрична провідність 1 м3 розчину, ув'язненого між платиновими електродами з поверхнею 1 м2, що знаходяться на відстані 1 м-кодом один від одного. Її визначають дослідним шляхом. Для цього досліджуваний розчин наливають в спеціальну судину, в якій на відстані 1 один від одного непорушно упаяні платинові пластинки площею S, покриті платиновою черню. Відношення 1/s для даної електричної судини – постійна величина, звана постійною судини. Для визначення постійною судини в нього наливають розчин речовини, питома електропровідність якої відома. Звичайно це 1 н, 0,1 н або 0,01 н розчини хлориду калію.
При вимірі електропровідності розчинів електролітів постійний струм не застосовується, оскільки при цьому протікатиме процес електролізу, який у свою чергу викличе зменшення концентрації речовини, поляризацію електродів і падіння провідності. Використовується змінний струм з частотою більше 1000 герц. Вимір електричної провідності розчинів робиться при постійній температурі. З підвищенням температури електрична провідність збільшується приблизно на 2% на кожен градус. Це пов'язано із зменшенням в'язкості середовища і міри гідратації іонів, унаслідок чого швидкість переміщення іонів до електродів збільшується і провідність розчинів зростає. Із розбавленням концентрованих розчинів електрична провідність їх спочатку зростає, досягає при деякій концентрації максимального значення, а потім починає падати. Пояснюється це тим, що у випадку сильних електролітів в початкові періоди розбавлення ослабляються міжіонні електричні взаємодії і збільшується швидкість руху іонів – переносників електрики. Розбавлення при цьому позначається мало. При подальшому розбавленні в сильнішій мірі починає з'являтися зменшення загальної концентрації електролітів. Найбільшу електропровідність мають розчини сильних кислот і лугів. Значно менше вона в солей. Найменша вона в слабких електролітів, оскільки в їх розчинах міститься мала кількість іонів.
Питома електропровідність - х – залежить від багатьох чинників, але найсильніше залежить вона від розбавлення розчину, тобто від концентрації. При вивченні розчинів частіше користуються еквівалентною електропровідністю - l- яку відносять до 1 кг-екв речовини. Еквівалентною електричною провідністю називається провідність стовпа розчину, що містить 1 кг-екв електроліту, ув'язненого між електродами, що знаходяться один від одного на відстані 1 м.
lV = х * V
де V – розведення розчину – число кубометрів розчину, в якому міститься 1 кг-екв розчиненого електроліту.
Еквівалентна електрична провідність розчину рівна його питомій електропровідності, помноженій на розведення розчину. Розмірність її См*м2*кг-екв-1. Знаючи, що розведення – величина, зворотна концентрації, можна записати:
lV = х/С
де С – концентрація, виражена числом кг-екв речовини в 1 м3. Із зростанням температури питома електропровідність безперервно збільшується.
Залежність еквівалентної електропровідності від розбавлення розчину набагато простіша, ніж х і однотипна для всіх електролітів. При нескінченно великому розбавленні еквівалентна електропровідність досягає свого найбільшого значення l¥. Відношення
a = fl = lV / l¥
називається коефіцієнтом електричної провідності, або удаваним ступенем дисоціації сильного електроліту. Він показує, в скільки разів дійсне значення електричної провідності менше ідеального. У слабких електролітів це відношення характеризує дійсне значення міри дисоціації електроліту в розчині.
Це співвідношення виведене Арреніусом і використовується для обчислення міри дисоціації електроліту в розчині.
Електричний струм в розчинах електролітів переноситься іонами – аніонами і катіонами. Від швидкості руху іонів до електродів залежить електропровідність даного розчину. Швидкості руху іонів надзвичайно малі. Це пояснюється тим, що:
1. іони рухаються у в'язкому середовищі розчинника, хаотичний рух молекул якого надає опір впорядкованому руху іонів до електродів;
2. на пересуванні іонів позначається гальмівний вплив хмари іонів протилежного знаку, яким оточений кожен іон в розчині;
3. на швидкість негативно впливає гідратація (сольватація) іонів. При цьому замість окремих іонів в розчинах пересуваються комплекси, що містять велику кількість молекул розчинника.
Швидкість руху іонів змінюватиметься залежно від різниці потенціалів, прикладеної до електродів. Тому абсолютними швидкостями руху іонів називаються швидкості їх, виражені в м/с при різниці потенціалів в 1 В/м довжини (розмірність м2/(с*В)). Найчастіше швидкості руху іонів обчислюють із значень електричної провідності. Найбільшими величинами абсолютних швидкостей володіють іони водню і гідроксильні іони. Цим і пояснюється краща електрична провідність розчинів сильних кислот і лугів в порівнянні з провідністю розчинів солей. Якщо позначити через Uк абсолютну швидкість руху катіонів електроліту, а через Uа – аніонів, то відносні швидкості виражатимуться як:
Uк Uа
nк= -----------; nа= ------------
 Uк + Uа Uк + Uа
Uк + Uа Uк + Uа
Їх називають також числами перенесення. Загальна кількість електроліту, що пройшов через електроліт, пропорційно сумі Uк + Uа. Числа перенесення характеризують долю електрики, переносимої до електродів катіонами і аніонами: nк + nа = 1. Оскільки перенесення електрики через розчин супроводиться зміною концентрації електроліту в приелектродному просторі, то, вимірявши цю зміну, можна визначити числа перенесення. І. Гитторфом було доведене, що
DСк/DСа = nа/nк
де DСк, DСа – зменшення концентрацій речовини в катода і анода.
Замість абсолютних швидкостей руху іонів можна користуватися пропорційними ним величинами подвіжностей lк і lа
lк = F+Uк; lа = F+Uа
де F – коефіцієнт пропорційності (число Фарадея). Із збільшенням концентрації розчинів унаслідок посилення гальмівної електростатичної дії іонів один на одного рухливість і електропровідність зменшуються. При цьому також позначається збільшення в'язкості розчину.
Ф. Кольрауш встановив наступний закон: Еквівалентна електрична провідність електролітів при нескінченно великому розбавленні при постійній температурі визначається лише сумою еквівалентних електричних провідності (подвіжностей) катіона і аніона:
l¥ = lк +lа или l¥ = F (Uк + Uа)
ЕЛЕКТРОЛІЗ
Електролізом називається хімічний розпад речовин під впливом електричного струму, що супроводжується виділенням на електродах продуктів розпаду і побічними явищами.
Електроліз здійснюють в спеціальних судинах – електролізерах, які заповнюються розчином або розплавом електроліту. У електроліт поміщають два електроди – анод (+) і катод (-), з’єднані з полюсами постійного джерела струму.
Електроліз можливий при накладенні на електроди зовнішньої напруги достатньої величини. Ця напруга викликає в електроліті і в зовнішньому ланцюзі проходження струму, а на поверхні електродів – електрохімічні реакції: катодні і анодні. Електричний струм в електроліті є процесом руху іонів до електродів.
Катіони – позитивні іони металів – пересуваються до катода, а аніони – негативно заряджені іони кислотних залишків – до анода. Досягши електродів іони нейтралізуються, перетворюються на атоми або молекули і виділяються на них. У зовнішньому ланцюзі при цьому безперервно переміщаються електрони від анода до катода. Отже, електроліз надає собою електронний процес окислення – відновлення іонів електролітів за рахунок електричної енергії з виділенням на електродах електрично нейтральних часток – атомів або молекул. На відміну від хімічних окислювально-відновних реакцій звичайного типа, окислення і відновлення при електролізі розділені в просторі. На катоді відбувається процес відновлення, а ан аноді – процес окисления.
Закономірності електролізу були встановлені М. Фарадеєм і отримали назву ЗАКОНІВ ФАРАДЕЯ:
1 закон Фарадея: кількість речовини, що виділилася при електролізі на електроді (m), прямо пропорціонально кількості електрики, що пройшла через електроліт (q):
m = k*q
де до - коефіцієнт пропорційності. Фізичний сенс до можна встановити, якщо прийняти q=1Кл. Тоді m = до. Тобто цим коефіцієнтом є кількість речовини в грамах, що виділяється на електроді при пропусканні 1 Кл електрики. Його називають електрохімічним еквівалентом. Знаючи, що кількість електрики дорівнює твору сили струму на якийсь час (q=І*t), отримуємо:
m=k*I*t
2 закон Фарадея: при пропусканні однакових кількостей електрики через розчини або розплави різних електролітів на електродах виділяється кількість речовини, пропорційна їх хімічним еквівалентам. Для виділення 1 г-еквіваленту речовини (Е) потрібно пропустити через електроліт одну і ту ж кількість електрики, рівну приблизно 96 500 Кл. Це число отримала назва постійної Фарадея. З пропорції Е: 96500 = до:1 можна виділити величину електрохімічного еквіваленту:
k = Е / 96500
Підставивши це значення в аналітичне вираження 1 закону Фарадея, отримаємо об'єднану формулу законів Фарадея:
m=  *I*t
*I*t
Кількість речовини, що виділилася при електролізі на електродах, прямо пропорційна кількості електрики, що пройшла, та зворотно - химічному еквіваленту даної речовини.
Кількість електрики, необхідна для виділення шляхом електролізу 1 г-екв будь-якої речовини, називається постійною Фарадея F=96500Кл. Законами Фарадея вперше був встановлений зв'язок між кількістю електрики і кількістю речовини, що виділилася. На цій основі можна шляхом кількісного визначення продуктів електролізу знаходити кількість пропущеної електрики (кулонометрія), робити висновок про кількісний вміст речовин в тих або інших зразках (електроаналіз, кулонометричний метод аналізу).
ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
Гальванічним елементом називається прилад, в якому енергія протікаючих хімічних реакцій перетворюється безпосередньо на електричну. У простому випадку гальванічні елементи складаються з двох різних металів, занурених в розчини електролітів, причому основні процеси протікають на контакті провідників 1 і 2 роди. Гальванічні елементи широко застосовуються в промисловості, на транспорті, у військовій справі, в медицині, в лабораторній практиці, інших областях. У гальванічних елементах безперервне протікають окислювально-відновні процеси. В результаті на електродах елементу підтримується різниця потенціалів, що визначає собою електрорушійну силу (ЕДС). При зануренні металу у воду іони металу, що входять в кристалічну решітку, під дією диполів води відриваються і переходять в розчин. Відбувається поверхневе розчинення металу, чому на пластинці залишаються в надлишку електрони. Вона заряджає негативно. Виникаючий негативний заряд буде все більшою мірою перешкоджати відходу позитивних іонів в розчин. Нарешті розчинення металу припиниться взагалі. Вірніше, між пластинкою і розчином встановиться динамічна рівновага. Воно подібно до рівноваги насиченої пари. Позитивні іони, що перейшли в розчин, через електростатичне тяжіння, розташовуються поблизу металевої поверхні у вигляді подвійного електричного шару. Одна частина його знаходиться на поверхні пластинки, а друга – в рідині, прилеглій до неї. На кордоні метал-рідина виникає рівноважна різниця потенціалів, звана електродним потенціалом. Для виникнення потенціалу необхідно два електроди з різних металів (гальванічна пара) занурити в розчини тих же солей і забезпечити контакт між електродами і розчинами. Така система називатиметься гальванічним елементом. Краще брати один метал благородний (позитивний електрод), а другий – ні (негативний електрод). При цьому на кордоні кожного з електродів з розчином виникає подвійний електричний шар, з'являються значні відмінності у величинах електродних потенціалів і досить велика величина ЕДС.
Розглянемо пристрій і роботу гальванічного елементу Якобі-Даніеля. Елемент Якобі-Даніеля складається з цинкового і мідного електродів, занурених відповідно в розчини сульфату цинку і сульфату міді. Розчини солей розділені пористою перегородкою, через яку можуть дифундувати іони розчинених речовин. Форма запису цього елементу наступна:
(+)Cu|Cu(SO4)||Zn(SO4)|Zn(-)

Однією вертикальною рисою показана межа між металом і розчином солі, а двома – межа розділу між розчинами двох солей. Ще при замкнених електродах між електродами і розчинами двох солей виникають рівноважні потенціали. Потенціал цинкової пластинки, завдяки появі на ній надлишку електронів, негативний (Е<0). Потенціал мідної пластинки, завдяки осадженню на ній іонів міді Cu2+, позитивний (Е>0). Рівновага порушується, якщо з'єднати провідником обидва електроди. При цьому надлишкові електрони з цинкової пластинки почнуть переходити на мідну, тобто між цинком і міддю в зовнішньому ланцюзі виникає електричний струм. Електрони, зустрічаючи на мідному електроді позитивно заряджені іони міді, нейтралізують їх. Під впливом чинників, що діють на кордоні метал-розчин солі того ж металу, деяка кількість іонів цинку знову перейде в розчин з цинкової пластинки, а на мідному електроді станеться осадження з розчину Cu(SО4) іонів мідь, яка нейтралізується електронами, що перейшли з цинкової пластинки, і так далі.
При роботі гальванічного елементу Якобі-Даніеля безперервно протікають хімічні окислювально-відновні процеси:
на мідному електроді Cu2+ + 2 е «Cu0
на цинковому Zn0 - 2е «Zn2+
Обидва ці процесу можна сумарно виразити так:
2е
Zn + Cu(SO4)«Cu + Zn(SO4)
Внутрішній ланцюг в даному гальванічному елементі замикається в результаті переміщення через пористу перегородку іонів SО42- назустріч іонам Zn2+. Якщо періодично міняти розчин сульфату міді, що витрачається при роботі, а також цинковий електрод, що піддається розчиненню, то практично від елементу Якобі-Даніеля можна отримувати струм тривалий час. Існують і інші гальванічні елементи, наприклад, елемент Вестону, званий нормальним елементом, – тобто таким елементом, який володіє сповна певною стійкою ЕДС, що не змінюється з часом і мало залежної від зміни температури. Обидва ці елементу – оборотні елементи: якщо включити зовнішню ЕДС, протилежно направлену по відношенню до елементу Якобі-Даніеля, довільно міняти її величину, то можна спостерігати такі явища:
- при рівності обох ЕРС струму в ланцюзі не буде і усередині ланцюга жодних електрохімічних реакцій не станеться;
- при зменшенні зовнішньої ЕРС елемент почне давати струм в результаті протікання електрохімічних реакцій розчинення цинку і осадження іонів міді;
- коли зовнішня ЕРС перевищить ЕРС елементу Якобі-Даніеля, то струм пройде через елемент у зворотному напрямі і викличе зворотні електрохімічні реакції: розчинення міді і осадження з розчину на цинковій пластинці іонів цинку.
Якщо цинковий і мідний електроди помістити не в розчини солей, а в розбавлений розчин сірчаної кислоти, то утворюється необоротний гальванічний елемент. При цьому цинк переходить в розчин, а на мідному електроді виділяється водень. На практиці використовуються головним чином оборотні елементи, ЕРС яких стійка, тоді як в необоротних елементах вона швидко падає. За міру ЕРС приймають різницю потенціалів дотичних тіл.
Знайдемо ЕРС гальванічного елементу Якобі-Даніеля. У місцях зіткнення різних ділянок ланцюга усередині елементу виникають скачки потенціалів Е1, Е2, Е3, Е4, де Е1 – різниця потенціалів на кордоні Cu –розчин Cu(SО4), Е2 – різниця потенціалів на межі Zn – розчин Zn(SО4), Е3 – різниця потенціалів на межі розчин Cu(SО4)|| розчин Zn(SО4), Е4 – різниця потенціалів на межі двох металів, що виникає при контакті цинкового електроду з мідним дротом, що сполучає в зовнішньому ланцюзі цинковий електрод з мідним. Е4 називають контактним потенціалом, і так як він дуже невеликий, в розрахунках їм нехтують. Різницю потенціалів Е3 (дифузний потенціал) сильно знижують спеціальними прийомами і також в розрахунках не враховують. Тому ЕРС гальванічного елементу в основному визначається різницею
Е = Е1 – Е2 = ЕCu/Cu2+ - Е Zn/Zn2+
У загальному випадку, ЕРС гальванічного елементу при 25оС визначають по формулі:
Е = Е1о – Е2о + 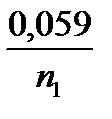 lg C1 -
lg C1 -  lg C2
lg C2
де n1 і n2 – валентність іонів 1 і 2 металів, С1 і С2 – концентрації іонів металів в розчинах їх солей. Для концентрованих розчинів замість концентрацій слід підставити їх активність а1 і а2:
Е = Е1о – Е2о +  lgа1 -
lgа1 -  lg а2
lg а2
Справжнє значення ЕДС гальванічного елементу не можна обчислити підключенням до електродів вольтметра, оскільки прилад при цьому покаже лише частину ЕДС, звану робочою напругою
ЕЛЕКТРОДНІ ПОТЕНЦІАЛИ
Гальванічний елемент складається з двох електродів, кожен з них має свій власний електричний потенціал, званий електродним потенціалом. Величина рівноважного електродного потенціалу ЕМе/Меn+ залежить від: природи металу, з якого виготовлений електрод, температури, концентрації іонів металу в розчині солі. Знаючи ці величини, можна обчислити електродний потенціал за формулою Нернста:
ЕМе/Меn+ = ЕоМе/Меn+ + 
де n – число електронів, яке втрачає атом металу, перетворюючись на іон Меn+, або набуває іон металу при відновленні, R – універсальна газова постійна, Т – абсолютна температура, F – постійна Фарадея, С – концентрація іонів металу в даному розчині, Ео – складова потенціалу, залежна від природи узятого металу (стандартний потенціал). Підставивши в рівняння числові значення R і F, отримаємо:
ЕМе/Меn+ = ЕоМе/Меn+ + 
Ео є електродним потенціалом даного металу, зануреним в розчин, в якому концентрація іонів металу рівна 1 г-іон на літр. Для виміру електродного потенціалу складають гальванічний ланцюг з досліджуваного електроду і електроду порівняння, потенціал якого точно відомий. Вимірюють ЕРС складеному ланцюгу:
Е = Е дослід. – Е ел. ср.
Як електрод порівняння використовують водневий або каломельного електроду.
КОНЦЕНТРАЦІЙНІ ЛАНЦЮГИ
Електричний струм можна отримати з елементу, обидва електроди якого зроблено з одного і того ж металу і занурено в розчини з різною концентрацією іонів цього ж металу. Такі елементи називаються концентраційними.
Оскільки метал однаковий, розчинність обох електродів буде одна і та ж. Проте відмінність в концентрації приводить до того, що рівновага в поверхні буде неоднаковою. У більш концентрованому розчині рівновага зрушена вліво в порівнянні з рівновагою в менш концентрованому розчині, тому на електроді в менш концентрованому розчині надлишок електродів виявиться великим і цей електрод буде більш негативним в порівнянні з іншим, менш негативним. При замиканні електродів виникає струм.
В результаті роботи елементу концентрації розчинів поступово вирівнюються. У менш концентрованому розчині вміст збільшується унаслідок переходу іонів металу з пластинки в розчин і вступи іонів залишку кислот через пористу перегородку, а в більш концентрованому розчині концентрація іонів металу зменшується, завдяки осадженню їх на поверхні пластинки.
Одночасно з цим іони кислотних груп, що звільнилися, переміщаються в менш концентрований розчин. ЕРС концентраційного елементу буде тим більше, чим сильніше розрізняються концентрації узятих розчинів. Як тільки концентрації вирівняються, елемент перестане давати струм. У будь-яких концентрованих гальванічних ланцюгах завжди позитивнішим є електрод, занурений в більш концентрований розчин, а більш негативним – електрод, що знаходиться у контакті з менш концентрованим розчином. ЕДС його обчислюють за формулою:
Е =  или Е =
или Е = 
Питання для самоперевірки
1. Що називається питомою та еквівалентною електропровідністю?
2. Що називається рухливістю іонів? Сформулюйте закон Кольрауша.
3. Яка причина виникнення потенціалу на електродах гальванічного лементу?
4. Що таке нормальний електродний потенціал?
5. Що показує ряд напруги металів?
6. В чому сутність кондуктометричного та потенціометричного титрування?
7. Сформулюйте закон розбавлення Освальда.
8. Як можна визначити рН розчину?
9. Напишіть електричні процеси, які проходять на електродах.
Не нашли, что искали? Воспользуйтесь поиском: