
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теоретическая часть. 5.1.1. Растворы. Растворы – гомогенные системы переменного состава, состоящие из 2-х или более компонентов
5.1.1. Растворы. Растворы – гомогенные системы переменного состава, состоящие из 2-х или более компонентов. Растворы характеризуются концентрацией, плотностью, удельной теплоемкостью, подчиняются законам Рауля и Вант-Гоффа. Относительное понижение давления пара над раствором пропорционально молярной доле растворенного летучего вещества (закон Рауля):
 (5.1)
(5.1)
где 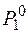 , Р – давление насыщенного пара растворителя соответственно над растворителем и над раствором.
, Р – давление насыщенного пара растворителя соответственно над растворителем и над раствором.
Повышение температуры кипения Δ Т кип, понижение температуры замерзания Δ Т зам пропорционально моляльной концент-рации растворенного вещества (Δ Т кип = К э· сm, Δ Т зам = K кр.· cm).
Криоскопическая константа К кр. – величина, показывающая на сколько градусов раствор, состоящий из 1 моля неэлектролита и 1000 г данного растворителя, замерзает ниже, чем чистый раство-
ритель: К кр. (Н2О) = 1,86 оС; К кр. (ССl4) = 29,8 oC.
 (5.2)
(5.2)
где m 0 – масса растворителя; m В – масса растворяемого вещества; М – молярная масса растворяемого вещества.
Концентрация растворов – количественное содержание растворенного вещества в данном растворе.
Процентная концентрация (%) – массовое содержание растворенного вещества в 100 массовых частях раствора.
Молярная концентрация (с) – число молей растворенного вещества в 1 л раствора.
Молярная концентрация эквивалента с экв (N) – число молей эквивалента вещества в 1 л раствора.
Моляльная концентрация (сm) – число молей растворенного вещества в 1000 г растворителя.
Плотность раствора (ρ, кг/м3) определяется ареометром.
Для определения концентрации растворов используют весовой, объемный, различные физико-химические методы анализа (фото-колориметрия, потенциометрия, полярография, кулонометрия и т.д.).
Растворы электролитов – ионные проводники с полярным или ионным типом связи в полярных растворителях, проводящие электрический ток в растворенном или расплавленном состоянии (растворы кислот, солей, оснований).
Распад веществ с ионным или полярным типом связи под действием полярных молекул растворителя – электролитическая диссоциация.
Растворы электролитов характеризуются активностью «а»:
а = γ· с, (5.3)
где γ – коэффициент активности; с – концентрация.
В разбавленных растворах γ → 1, активность соизмерима с концентрацией.
Растворы электролитов характеризуются активностью (а), электропроводностью (χ, См∙см-1), степенью диссоциации (α), изотоническим коэффициентом (i), константой диссоциации К дис. Растворы электролитов подчиняются законам идеальных растворов при введении изотонического коэффициента i, величина которого зависит от числа частиц, находящихся в единице объема раствора (рис. 5.1). В таблицах приложения приведены значения констант диссоциации, электропроводности электролитов.
Константа равновесия электролитической диссоциации – константа диссоциации.
Уксусная кислота СН3СООН диссоциирует по уравнению
СН3СООН 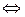 СН3СОО
СН3СОО 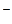 + Н+; (5.4)
+ Н+; (5.4)
К дис =  (5.5)
(5.5)
Растворение – физико-химический процесс взаимодействия растворяемого вещества с растворителем (сольватация, гидратация). При растворении сильных электролитов осуществляется межионное взаимодействие, количественной характеристикой которого является ионная сила раствора I, из которой можно определить γ:
I = ½ Σ ci ·z  , (5.6)
, (5.6)
где с i – концентрация; zi – заряд иона.
Степень диссоциации можно определить, измерив молярную электрическую проводимость (μ) раствора электролита, так как α = = μ/μD.
Молярная электрическая проводимость μD (см2·моль-1·См) (Cм – сименс = Ом-1) – электрическая проводимость раствора, содержащего 1 моль растворенного вещества, заключенного между электродами, находящимися на расстоянии 1 см.
Удельная электрическая проводимость (См∙см-1) связана с молярной электрической проводимостью μ соотношением
μ =  . (5.7)
. (5.7)
Водородный показатель (рН). Для количественной характе-ристики реакции среды (кислая, щелочная) применяют водородный показатель:
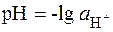 . (5.8)
. (5.8)
При 293 К в нейтральных средах  = 10-7 моль/л (рН = 7), в кислых
= 10-7 моль/л (рН = 7), в кислых  > 10-7 моль/л (рН < 7), в щелочных
> 10-7 моль/л (рН < 7), в щелочных  < 10-7 моль/л (рН > 7).
< 10-7 моль/л (рН > 7).
Для щелочных растворов используется  .
.
Определение рН производится с помощью кислотно-основных индикаторов и рН-метров.
Между растворами электролитов необратимо происходят ионно-обменные реакции с образованием малорастворимых веществ, малодиссоциируемых соединений (вода), газов и комплексных соединений.
Произведение растворимости – произведение концентраций ионов малорастворимого электролита, содержащихся в свободном виде в насыщенном растворе например, малорастворимого соединения AgCl: ПРAgCl = [Ag+]∙[Cl–] =1,73·10-10.
Гидролиз солей. Реакция химического обменного взаимодействия растворенного вещества с водой называется гидролизом. Гидролизу подвергаются соли, образованные сильным основанием и слабой кислотой, например, Na2CO3; соли, образованные слабым основанием и сильной кислотой (ZnCl2), и соли, образованные слабой кислотой и слабым основанием ((NH4)2CO3).
5.1.2. Коллоидные растворы. Дисперсные системы, степень дисперсности которых находится в пределах 106 – 109 м-1, образуют коллоидные растворы. Коллоидные растворы, для краткости называемые золями, по внешнему виду трудноотличимы от обычных истинных или молекулярных растворов, но по размерам и состоянию частиц дисперсной фазы, а следовательно, и по физико-химическим свойствам золи сильно отличаются от истинных растворов. Коллоидные растворы являются микрогетерогенными системами и обладают рядом специфических свойств. Хотя золи и свободно фильтруются через бумажные фильтры, частицы дисперсной фазы задерживаются полупроницаемыми мембранами. Они оптически прозрачны, однако свет, проходя через коллоидный раствор, претерпевает дифракционное рассеивание (эффект Тиндаля) вследствие соизмеримости длины волны света с размерами дисперсных частиц.
Если дисперсионная среда – вода, то коллоидный раствор называют гидрозолем. Золи, частицы дисперсной фазы которых связаны с молекулами растворителя, называют лиофильными (в частности, гидрофильными). Гидрофильные золи иодида серебра, гидроксида железа. Коллоиды, в которых отсутствует прочное взаимодействие между дисперсными частицами и растворителем, называют лиофобными (гидрофобными). Гидрофобны золи серы и канифоли.
Частицы дисперсной фазы дисперсной системы представляют мельчайшие осколки кристалликов или аморфного твердого вещества либо мельчайшие капельки жидкости, взвешенные в дисперсионной среде, и благодаря высокоразвитой поверхности обладают огромной поверхностной энергией. Поэтому на межфазовой границе частица - среда хорошо адсорбируются ионы и молекулы растворителя или растворенных веществ. В результате возникает двойной электри-ческий слой. На рис. 5.2 представлена схема частицы дисперсной фазы (мицеллы) коллоидного раствора йодида серебра при избытке KI:
{[(AgI) n I  ] (m – x) K+} x K+.
] (m – x) K+} x K+.
|

|
|


|
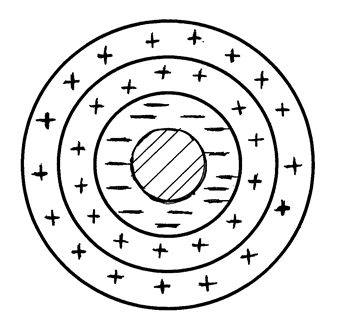
Рис. 5.2. Мицелла золя йодида серебра в избытке KI в растворе
Ядро и адсорбционный слой йод-ионов образуют кристаллическую микрофазу. Поверхностный слой адсорбированных ионов йода образует твердую обкладку («стенку») двойного электрического слоя. Электростатически притягиваемые ионы калия (противоионы) расположены в жидкой фазе – дисперсионной среде. Они образуют жидкостную обкладку двойного электрического слоя. Как видно из рис. 5.2, частицы твердой обкладки двойного слоя (I  ) равномерно и плотно сосредоточены на поверхности ядра. Ионы жидкостной обкладки находятся в двух состояниях: одна часть их плотно прижата к твердой поверхности, а другая находится в подвижном или диффузионном состоянии, создавая диффузную часть жидкостной обкладки.
) равномерно и плотно сосредоточены на поверхности ядра. Ионы жидкостной обкладки находятся в двух состояниях: одна часть их плотно прижата к твердой поверхности, а другая находится в подвижном или диффузионном состоянии, создавая диффузную часть жидкостной обкладки.
Наличие заряда на поверхности дисперсных частиц обусловливает электрокинетические свойства и является одной из основных причин устойчивости коллоидных растворов и других дисперсных систем.
Микрогетерогенные коллоидные растворы термодинамически нестабильны, по крайней мере, по двум причинам: во-первых, из-за большой плотности дисперсных частиц по сравнению с дисперсионной средой; во-вторых, из-за стремления дисперсных частиц к уменьшению поверхностной энергии путем их укрупнения. Соответственно различают два вида устойчивости коллоидных или дисперсных систем: кинетическую и агрегативную.
Постоянное броуновское движение дисперсных частиц препятствует их отделению от дисперсионной среды и обусловливает их кинетическую устойчивость. Одноименный электрический заряд мицелл предотвращает укрупнение частиц и обусловливает агрегативную устойчивость золя.
Нарушение двойного электрического слоя мицеллы, например, в присутствии избытка электролита, снижает стабильность золя и приводит к его коагуляции – отделению дисперсной фазы от дисперсионной среды. Коагуляция коллоидного раствора может быть вызвана повышением температуры или сильным охлаждением, центрифугированием и другими воздействиями.
Коллоидные растворы получают двумя противоположными путями: дроблением вещества до желаемой дисперсности (диспергированием) и соединением молекул, атомов или ионов в агрегаты коллоидной дисперсности (конденсированием). Оба метода осуществляются различными способами.
5.1.3. Грубодисперсные системы. Эмульсии. Дисперсную сис-тему, состоящую из двух взаимно нерастворимых или ограниченно растворимых жидкостей, когда одна диспергирована в другой, называют эмульсией. От коллоидных растворов эмульсии отличаются более низкой дисперсностью (Д > 107 м-1), что обусловливает их особенности. Так, частицы дисперсной фазы эмульсии видимы в оптический микроскоп, они не проходят через поры бумажного фильтра, эмульсия из двух чистых жидкостей малоустойчива.
Обычно одна из двух жидкостей, образующих эмульсии, – вода, вторая – масло, бензол, продукты переработки нефти и т.п. Водную фазу обозначают буквой В, органическую (маслоподобную) – М.
Запись М/В означает, что органическая жидкость, например, бензол, диспергирована в воде. Эмульсию, в которой дисперсионной средой является вода (М/В), называют прямой эмульсией. Обратной называется эмульсия с органической дисперсионной средой (В/М).
Тип эмульсии (прямой и обратной) определяют экспериментально, например, путем окрашивания одной из жидкостей дисперсной системы.
Эмульсии, как и дисперсные системы вообще, кинетически и агрегативно малоустойчивы. Для придания устойчивости в дисперсную систему из двух чистых жидкостей вводят третий компонент – эмульгатор. Лучшими эмульгаторами являются, как установлено практикой, растворимые в воде мыла – натриевые и калиевые соли ненасыщенных углеводородных кислот с числом атомов углерода от 8 до 20. Например, олеат натрия, формула которого
СН3―(СН2)7―СН=СН―(СН2)7 ― СООNa,
может быть условно изображена RCOONa, где R – углеводородный радикал. Эти мыла нерастворимы в органических жидкостях – маслах.
На тип возникающей эмульсии решающее влияние оказывает характер эмульгатора. Заменяя или изменяя химический состав эмульгатора, эмульсию одного типа можно превратить в эмульсию другого типа. Такой переход называют обращением фаз или инвертированием эмульсии. Так, если прямая эмульсия М/В получена с использованием натриевого мыла RCOONa, то при введении в дисперсную систему соли двух- или трехвалетного металла, например, цинка, в дисперсной системе образуется нерастворимое мыло Zn(RCOO)2 и возникает обратная эмульсия В/М.
На практике при очистке отработанных эмульсий и смазывающе-охлаждающих жидкостей, используемых при обработке металлов резанием, а также в других случаях возникает необходимость разрушения эмульсии. С этой целью, как и для коагуляции коллоидных растворов, применяют химические, термические и механические методы.
Не нашли, что искали? Воспользуйтесь поиском: