
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Отличия реальных газов и паров от идеальных. Процессы парообразования. pv-диаграмма водяного пара 2 страница
Рассмотрим произвольный ТП 1-2 в координатах Q=f(t), где Q – подведенная теплота в Дж, t – температура в 0С. Тогда Cm= tgα, C= tgβ.
Если ТС – однородное рабочее тело, то в расчетах применяются относительные теплоемкости:
- удельная теплоемкость – теплоемкость, отнесенная к 1 кг вещества с=С/m, Дж/кгК.
- молярная теплоемкость – теплоемкость, отнесенная к 1 молю вещества 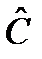 =С/n, Дж/мольК.
=С/n, Дж/мольК.
- объемная теплоемкость – теплоемкость, отнесенная к 1 м3 вещества С’=С/n, Дж/ м3К.
Теплоемкость – функция процесса и зависит от рода рабочего тела, характера процесса и параметров состояния. Так, теплоемкость в процессе с постоянным давлением называется изобарной теплоемкостью:
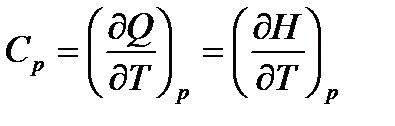 , (23)
, (23)
где Н, Дж – энтальпия.
Теплоемкость в процессе с постоянным объемом называется изохорной теплоемкостью:
 , (24)
, (24)
где U, Дж – внутренняя энергия.
Уравнение Майера связывает между собой теплоемкости идеального газа в процессах p=const и v=const.
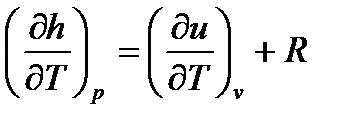 , (25)
, (25)
где R – удельная газовая постоянная, зависящая от рода газа, или 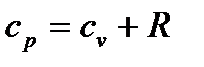 , Дж/кгК.
, Дж/кгК.
Отношение изобарной теплоемкости к изохорной теплоемкости называется показателем адиабатного процесса:
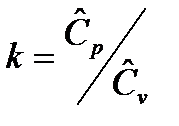 . (26)
. (26)
Для реальных газов показатель k зависит от температуры. Для воздуха и двухатомных газов показатель температуры k=1.4.
Для смеси газов теплоемкость вычисляется как сумма теплоемкостей газов, входящих в состав смеси:
 . (27)
. (27)
Сущность второго закона термодинамики. Различные формулировки закона. Вечный двигатель второго рода (АЗ: 2, СРС: 1)
Второй закон термодинамики устанавливает существование у всякой равновесной термодинамической системы однозначной функции состояния – энтропии S.
Понятие энтропии вводится в феноменологической термодинамике в помощью выражения dS=δQ/T, в соответствии с которым при подводе к ТС порции теплоты δQ энтропия системы возрастает. Температура Т в этом выражении есть температура на границе ТС в точке, где подводится порция теплоты δQ.
ТС находится в состоянии равновесия, если после ее изоляции от окружающей среды в ней не наблюдается никаких изменений, и в неравновесном состоянии, если после ее изоляции в ней обнаруживаются какие-либо изменения. Эти изменения в изолированной системе протекают самопроизвольно, и со временем система приходит в равновесное состояние. Процесс является неравновесным, если при его совершении ТС хотя бы в одной точке процесса находится в неравновесном состоянии.
Все равновесные процессы - обратимые, а неравновесные – необратимые процессы. Процесс называется необратимым, если суммарный запас энергии направленного, упорядоченного движения частиц ТС (работы) уменьшается, и обратимым, если этот запас энергии сохраняется. В необратимых процессах происходит диссипация энергии упорядоченного движения материи в энергию теплового, неупорядоченного движения, которую нельзя превратить ни в какой другой вид энергии в обратном направлении.
Второй закон термодинамики является обобщением опытных данных, указывает на особый характер протекания тепловых процессов и устанавливает пределы возможных превращений теплоты в работу. Этот закон позволяет определить направление и условия протекания любого термодинамического процесса. Дело в том, что тепловые процессы, удовлетворяющие первому закону термодинамики, подразделяются на самопроизвольные, протекающие без внешнего воздействия и на процессы, которые не могут происходить в данных условиях без внешнего воздействия.
В изолированной ТС самопроизвольные процессы протекают в направлении достижения равновесии системы. При этом работа преобразуется в теплоту, а теплота переходит лишь от тела с более высокой температурой к телу с более низкой температурой Процессы с превращением теплоты в работу в изолированной системе самопроизвольно идти не могут.
Наиболее краткой формулировкой 2-го закона термодинамики является формулировка Томсона-Кельвина: Теплота, содержащаяся в окружающей среде, не может быть превращена в работу теплового двигателя, если температура всех окружающих тел будет одинаковой, т.е. вечный двигатель 2-го рода неосуществим. Вечный двигатель второго рода – это двигатель, который производил бы механическую работу исключительно за счет теплоты окружающей среды с одинаковой температурой во всех ее точках.
Для обратимых процессов при подводе теплоты δQ извне изменение энтропии ТС равно изменению энтропии окружающей среды с обратным знаком, т.е.
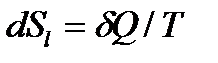 , (28)
, (28)
а в случае необратимых процессов
 . (29)
. (29)
При протекании процессов внутри ТС энтропия может только расти, т.е. 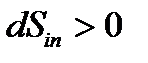 .
.
Различные формы записи объединенных уравнений. Характеристические функции и дифференциальные соотношения. Дифференциальные уравнения состояния, внутренней энергии, энтальпии и энтропии (АЗ: 4, СРС: 2)
Для сложных открытых ТС уравнения первого закона термодинамики, выраженные через изменения внутренней энергии и энтальпии имеют вид:
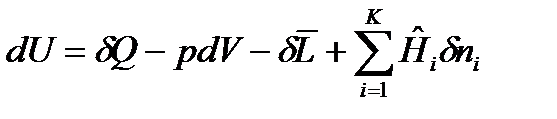 , (30)
, (30)
где 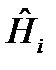 - молярная энтальпия i-го вещества,
- молярная энтальпия i-го вещества,
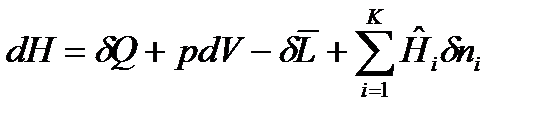 . (31)
. (31)
Математическое выражение 2-го закона термодинамики:
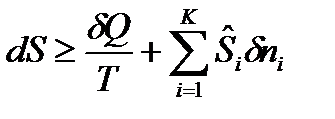 , (32)
, (32)
представим в виде  и подставим в уравнение 1-го закона термодинамики.
и подставим в уравнение 1-го закона термодинамики.
Тогда получим объединенные выражения для изменения внутренней энергии  и энтальпии
и энтальпии 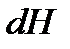 :
: 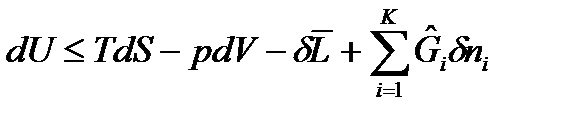 , (33)
, (33)
 , (34)
, (34)
где 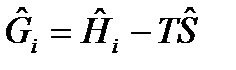 - молярная свободная энергия Гиббса, Дж/моль.
- молярная свободная энергия Гиббса, Дж/моль.
Свободная энергия Гиббса, является функцией состояния. Функцией состояния является также свободная энергия Гельмгольца:
 , Дж. (35)
, Дж. (35)
Дифференциалы dF и dG – полные дифференциалы.
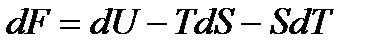 , (36)
, (36)
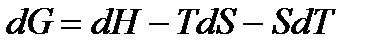 . (37)
. (37)
Характеристической функцией называется функция состояния ТС, позволяющая при соответствующем выборе независимых переменных (при определенных условиях сопряжения ТС с окружающей средой) выражать через свои производные наиболее просто и в явном виде термодинамические параметры, характеризующие свойства ТС. Построение термодинамического анализа на этих свойствах характеристических функций составляет основу метода характеристических функций.
Рассмотрим простую (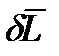 =0), закрытую (
=0), закрытую (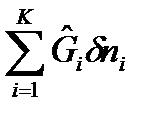 =0) ТС. Тогда для обратимых процессов объединенные выражения 1-го и 2-го законов термодинамики будут иметь вид:
=0) ТС. Тогда для обратимых процессов объединенные выражения 1-го и 2-го законов термодинамики будут иметь вид:
 , (38)
, (38)
 , (39)
, (39)
 , (40)
, (40)
 . (41)
. (41)
Каждое из этих уравнений (38)-(41) связывает пять переменных величин, которые зависят лишь от состояния ТС и не зависят от пути процесса. Функции U, H, F, G являются характеристическими только при определенном выборе независимых переменных: 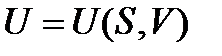 ,
, 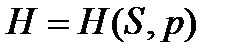 ,
,  ,
,  . Полные дифференциалы функций U, H, F, G имеют вид:
. Полные дифференциалы функций U, H, F, G имеют вид:
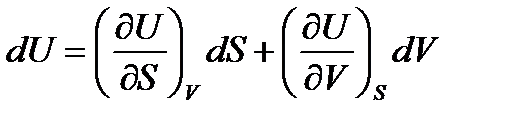 , (42)
, (42)
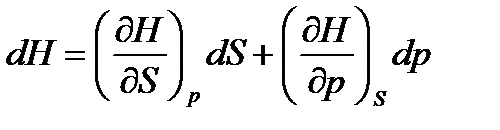 , (43)
, (43)
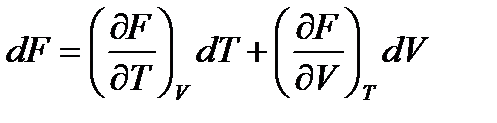 , (44)
, (44)
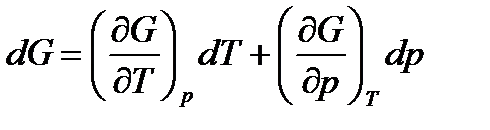 . (45)
. (45)
Сопоставляя уравнения (38) и (42) можно наиболее просто выразить неизвестные параметры – температуру Т и давление pс помощью частных производных внутренней энергии по энтропии Sи по объему V:
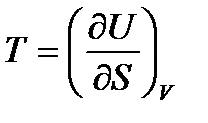 ,
, 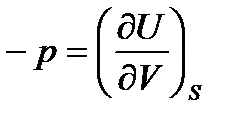 . (46)
. (46)
По аналогии выразим другие неизвестные параметры:
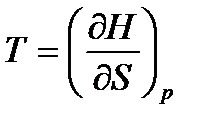 ,
, 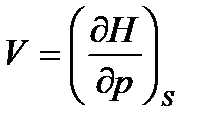 , (47)
, (47)
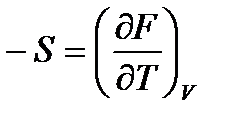 ,
,  , (48)
, (48)
 ,
, 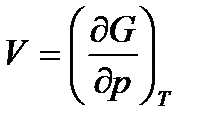 . (49)
. (49)
Согласно свойству полного дифференциала вторая смешанная производная от функции U не зависит от порядка дифференцирования, т.е.:
 , или (50)
, или (50)
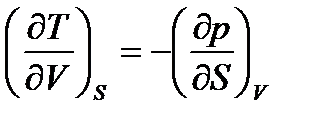 .
.
По аналогии для функций H, F, G получим:
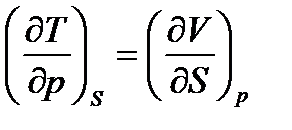 , для H, (51)
, для H, (51)
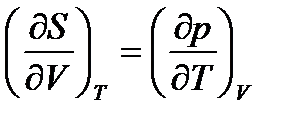 , для F, (52)
, для F, (52)
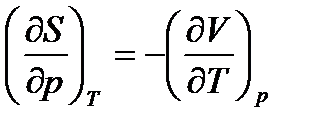 , для G. (53)
, для G. (53)
Уравнения (50)-(53) называются дифференциальными соотношениями взаимности или уравнениями Максвелла.
Соотношение между изобарной и изохорной теплоемкостями в общем случае (АЗ: 2, СРС: 1)
Функция состояния ТС – энтропия может быть представлена в виде функциональной связи S=S(T, V). Дифференциал энтропии – полный дифференциал, т.е.
 . (54)
. (54)
Разделим уравнение (54) на dT и умножим на Т при условии p=const. Тогда имеем:
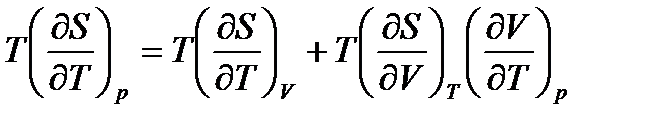 . (55)
. (55)
По определению 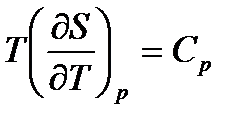 и
и  . После их подстановки в (55) получим:
. После их подстановки в (55) получим:
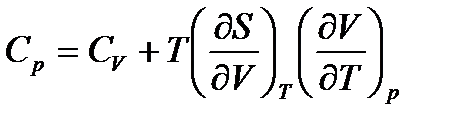 . (56)
. (56)
Производная 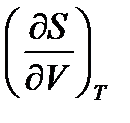 включает энтропию и неудобна в расчетах. После ряда замен получим:
включает энтропию и неудобна в расчетах. После ряда замен получим:
 . (57)
. (57)
Продифференцируем уравнение состояния идеального газа  . Тогда
. Тогда
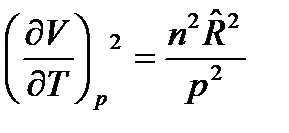 и
и  .
.
После подстановки этих выражений в (57) получим:
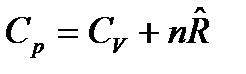 . (58)
. (58)
Условия равновесия однородных и неоднородных систем (АЗ: 2, СРС: 1)
Любая ТС может находиться либо в равновесном, либо в неравновесном состоянии. Условия термодинамического равновесия для различных сопряжений ТС с окружающей средой с фиксацией двух параметров определяются по поведению характеристических функций, которые позволяют судить о направлении протекания химических реакций и фазовых переходов.
Для простых (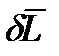 =0) и закрытых (
=0) и закрытых (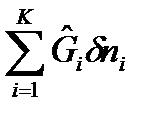 =0) и закрытых ТС при фиксации двух параметров имеем:
=0) и закрытых ТС при фиксации двух параметров имеем:
 ,
,
 ,
,
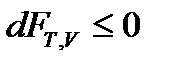 , (59)
, (59)
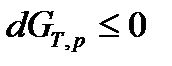 .
.
Для необратимых процессов:
 ,
,
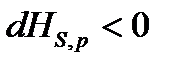 ,
,
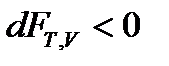 , (60)
, (60)
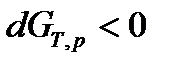 ,
,
т.е. необратимые, неравновесные процессы в простой, закрытой ТС протекают в направлении уменьшения соответствующего термодинамического потенциала. В состоянии равновесия значение соответствующего потенциала достигает минимума, и условия равновесия ТС имеют вид:
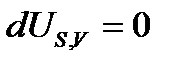 ,
,
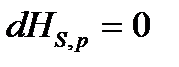 ,
,
 , (61)
, (61)
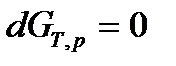 .
.
Рассмотрим равновесие закрытых ТС, у которых, кроме условий сопряжения с окружающей средой, имеет место воздействие лишь одной силы немеханического характера. Тогда объединенные выражения 1-го и 2-го уравнений термодинамики примут вид:
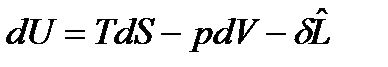 ,
,
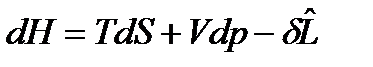 ,
,
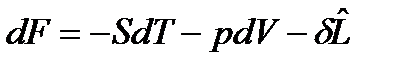 , (62)
, (62)
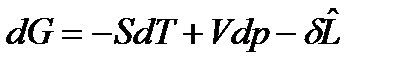 .
.
Работу немеханического характера 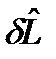 в (62) будем представлять в виде:
в (62) будем представлять в виде:
 , Дж, (63)
, Дж, (63)
где А – термодинамическое сродство, Дж/моль,  - путь термодинамического процесса, моль.
- путь термодинамического процесса, моль.
Термодинамическое сродство вводится соотношением:
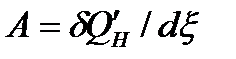 , Дж/моль, (64)
, Дж/моль, (64)
где 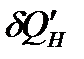 – некомпенсируемая теплота, т.е. количество работы, которое диссипировало (рассеялось) в энергию теплового движения частиц на длине пути процесса. Т.о., термодинамическое сродство – это количество энергии упорядоченного движения частиц (работы), которое диссипировало (рассеялось) на длине пути процесса внутри ТС. При А=0 – процесс обратимый, при А>0 – процесс необратимый. После подстановки выражения (63) в уравнения (62) получим:
– некомпенсируемая теплота, т.е. количество работы, которое диссипировало (рассеялось) в энергию теплового движения частиц на длине пути процесса. Т.о., термодинамическое сродство – это количество энергии упорядоченного движения частиц (работы), которое диссипировало (рассеялось) на длине пути процесса внутри ТС. При А=0 – процесс обратимый, при А>0 – процесс необратимый. После подстановки выражения (63) в уравнения (62) получим:
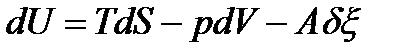 ,
,
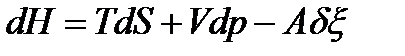 ,
,
 , (65)
, (65)
 .
.
Таким образом, 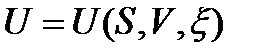 ,
, 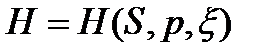 ,
,  ,
, 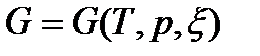 и при фиксации двух первых параметров в уравнениях (65) будем иметь:
и при фиксации двух первых параметров в уравнениях (65) будем иметь:
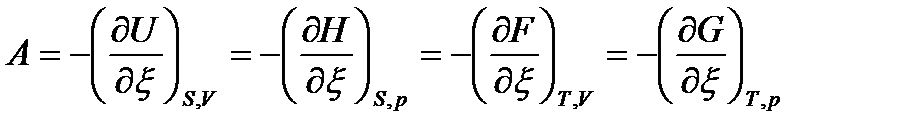 . (66)
. (66)
Следовательно, термодинамическое сродство определяется через частные производные характеристических функций по пути процесса.
Примером термодинамического сродства является химическое сродство, В этом случае величина пути процесса называется пробегом химической реакции.
Равновесное состояние ТС можно охарактеризовать также по изменению энтропии. При необратимых, неравновесных процессах внутри адиабатной, закрытой ТС изменение энтропии 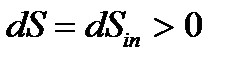 , т.е. энтропия растет и достигает максимума в состоянии равновесия:
, т.е. энтропия растет и достигает максимума в состоянии равновесия:  ,
, 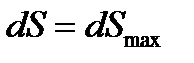 .
.
Фазовые переходы I рода. Уравнение Клапейрона-Клаузиуса. Фазовые переходы II рода (АЗ: 2, СРС: 1)
Переход вещества от одной фазы в другую – фазовый переход – всегда связан с качественными изменениями свойств вещества. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую).
Различают фазовые переходы двух родов. Фазовый переход первого рода (например, плавление, кристаллизация и т.д.) сопровождается поглощением или выделением вполне определённого количества теплоты, называемой теплотой фазового перехода.
Пар – это газ над поверхностью жидкости, а испарение – это переход из жидкой фазы в газообразную (паровую). Кипение – это превращение жидкости в пар по всему ее объему.
Конденсация – это переход из паровой фазы в жидкую. Сублимация – переход из твердой фазы в газообразную. Десублимация – переход из газовой фазы в твердую.
Равномерная смесь мельчайших частиц жидкости и сухого насыщенного пара образует влажный насыщенный пар. При переходе всей жидкости в пар образуется сухой насыщенный пар. Насыщенный пар – это пар, находящийся в равновесии с жидкостью. Ненасыщенный пар – это пар, не находящийся в равновесии с жидкостью
Перегретым паром называется пар, температура которого выше температуры сухого насыщенного пара при данном давлении.
Степенью сухости:  , или
, или 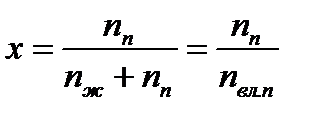 , называется массовая или молярная доля сухого насыщенного пара в смеси пара (индекс «п») с жидкостью (индекс «ж»). Для горячей воды при температуре насыщения (кипения) – ts степень сухости х=0. Для сухого насыщенного пара степень сухости х=1. Величина: у=1-х, называется степенью влажности пара.
, называется массовая или молярная доля сухого насыщенного пара в смеси пара (индекс «п») с жидкостью (индекс «ж»). Для горячей воды при температуре насыщения (кипения) – ts степень сухости х=0. Для сухого насыщенного пара степень сухости х=1. Величина: у=1-х, называется степенью влажности пара.
Фазовая диаграмма р-Т для однокомпонентной равновесной термодинамической системы имеет вид, представленный на рисунке:
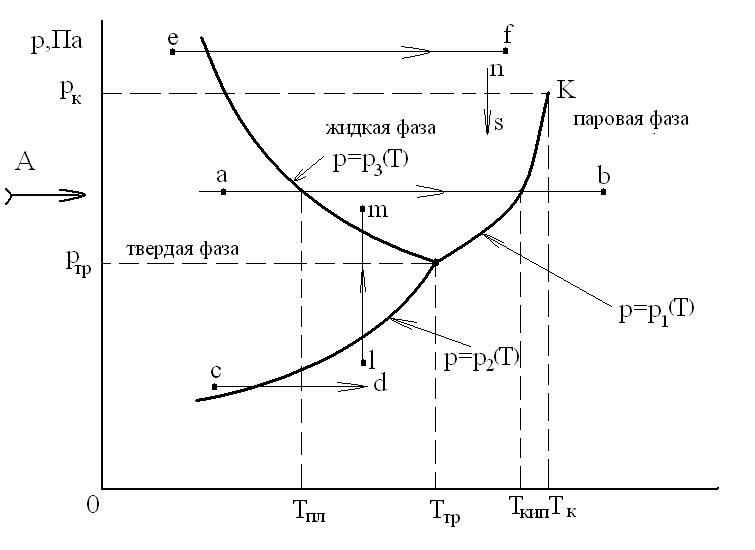
Равновесное существование 3-х фаз возможно только при определенных давлении ртр и температуре Ттр. Это состояние ТС называется тройной точкой, и что число степеней ее свободы равно нулю. Для воды значения: Ттр=273,15К и ртр=1 физич. атм.
Для двухфазной ТС существует однозначная зависимость р=р(Т), т.е. ТС обладает одной степенью свободы.
В однофазной ТС независимо могут изменяться два термодинамических параметра: давление р и температура Т (ТС обладает двумя степенями свободы).
На фазовой р-Т диаграмме линия р=р1(Т) является кривой парообразования (испарения), на которой сосуществуют, т.е. находятся в равновесии, жидкая и паровая фазы.
Линия– р=р2(Т) - это кривая сублимации, на которой находятся в равновесии твердая и паровая фазы. При этом подводятся энергия, равная теплоте сублимации.
Линия р=р3(Т) - кривая плавления, на которой находятся в равновесии твердая и жидкая фазы.
Кривая парообразования р=р1(Т) оканчивается для каждого вещества в точке К при определенных критических значениях давления рк и температуры Тк.
Получим условие равновесия ТС, рассматривая бесконечно малый цикл Карно (обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов) при переходе «жидкость-пар» в p-v и T-s координатах:
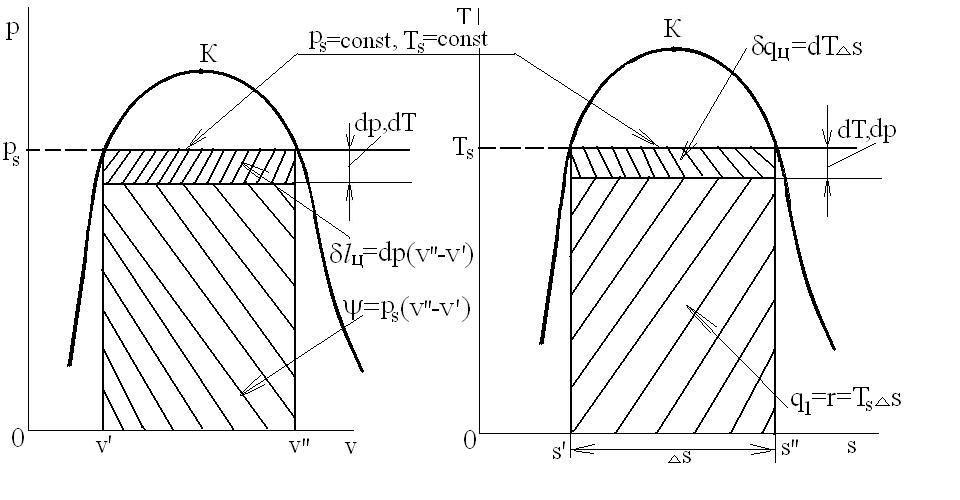
Термический КПД цикла Карно равен:
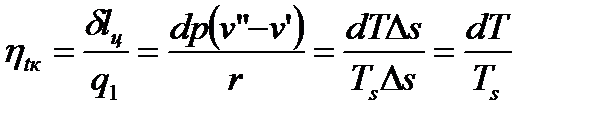 . (67)
. (67)
Отсюда имеем:
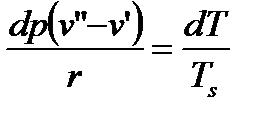 , или (68)
, или (68)
 . (69)
. (69)
Это уравнение Клапейрона-Клаузиса.
При переходе «жидкость-пар» удельный объем растет, т.е. 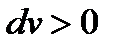 и
и 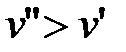 , теплота парообразования
, теплота парообразования 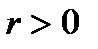 и
и 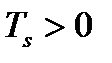 . Поэтому величина
. Поэтому величина 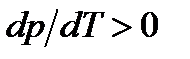 , т.е. положительна. Таким образом, давление насыщенного пара над жидкостью для фаз, находящихся в равновесии, всегда возрастает с ростом температуры.
, т.е. положительна. Таким образом, давление насыщенного пара над жидкостью для фаз, находящихся в равновесии, всегда возрастает с ростом температуры.
Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объёма, называются фазовыми переходами второго рода. Эти переходы характеризуются постоянством объёма и энтропии, но скачкообразным изменением теплоёмкости. Примерами фазовых переходов второго рода являются: переход ферромагнитных веществ (железа, никеля) при определённых давлении и температуре в парамагнитное состояние; переход металлов и некоторых сплавов при температуре, близкой к 0К, в сверхпроводящее состояние, характеризуемое скачкообразным уменьшением электрического сопротивления до нуля; превращение обыкновенного жидкого гелия при Т=2,9К в другую жидкую модификацию, обладающую свойствами сверхтекучести.
Отличия реальных газов и паров от идеальных. Процессы парообразования. pv-диаграмма водяного пара
Идеальный газ — газ, в котором взаимодействие между молекулами сводится к парным столкновениям, причём время межмолекулярного столкновения много меньше среднего времени между столкновениями. Идеальный газ является простейшим модельным объектом молекулярной физики.
Уравнение состояния идеального газа
Реальный газ — газ, в котором учитывается взаимодействие между молекулами. Уравнение состояния реального газа часто строится методами теории возмущений, при этом отличие от уравнения состояния идеального газа описывается набором вириальных коэффициентов.
Паровая диаграмма p-v. Расчет количества теплоты, затраченной на процесс парообразования
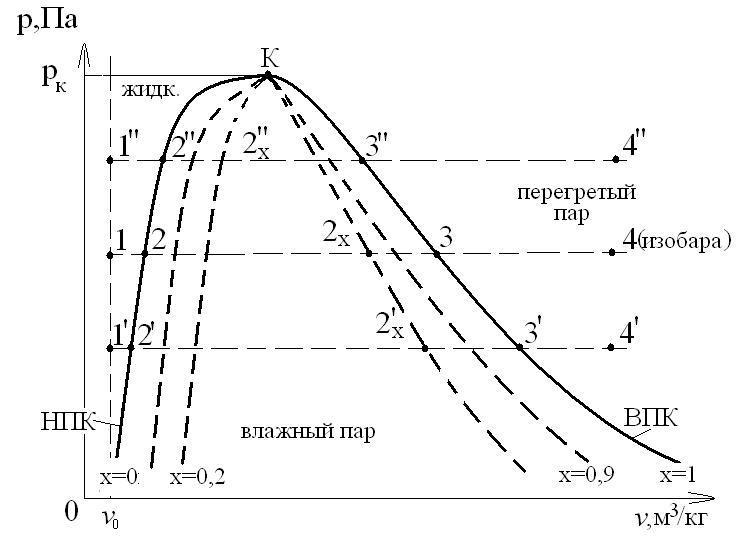
НПК – нижняя (левая) пограничная кривая (х=0) отражает состояние горячей воды при температуре насыщения t=ts=tкип.
ВПК – верхняя (правая) пограничная кривая (х=1) отражает состояние сухого насыщенного пара. Равновесие системы: «жидкость-пар», - динамическое равновесие. При рассмотрении процессов с паром используются следующие стандартные обозначения параметров, представленные в виде таблицы:
| № п/п | Состояние | Обозначения параметров | Точка на диаграмме |
| Горячая вода при t=ts(х=0) НПК | 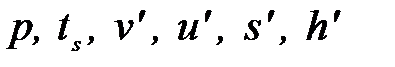
| т.2 | |
| Сухой насыщенный пар (х=1), ВПК | 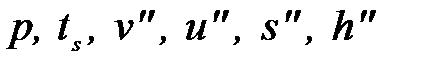
| т.3 | |
| Влажный пар при степени сухости «х» | 
| т.2х | |
| Перегретый пар | 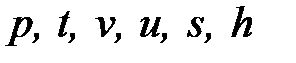
| т.4 |
Образование водяного пара проходит 3 стадии:
Подогрев жидкости от 00С до температуры кипения (насыщения) ts (процесс 1-2).
Парообразование при ts=const (ts=  ).
).
Перегрев пара от ts до tпер.
Рассмотрим процесс «1-2» - нагрев жидкости. В т.1 температура холодной воды t0=00С при давлении р. При подводе теплоты q по изобаре (p=const) вода нагревается от 00С до ts:
В изобарно-изотермическом процессе парообразование «2-3» (ps=const, Ts=const) подводится теплота парообразования.
В процессе «3-4» теплота qпер идет на перегрев пара от температуры ts до tпер при p=const:
Пар высокого давления требует меньше теплоты для своего образования, т.е. является более экономичным при р>40.105Па.
1.7.2. Основные параметры воды и водяного пара. Таблицы водяного пара. Ts и hs диаграммы. Влажный воздух (АЗ: 2, СРС: 1)
Степенью сухости:  , (70)
, (70)
или 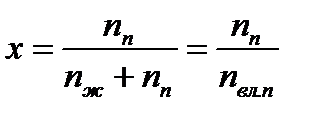 , (71)
, (71)
называется массовая или молярная доля сухого насыщенного пара в смеси пара (индекс «п») с жидкостью (индекс «ж»).
Паровая диаграмма «T-s»
При 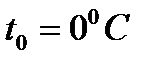 удельная энтропия
удельная энтропия 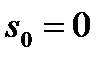 . Тогда процессы нагрева жидкости (1-2), парообразования (2-3) и перегрева пара (3-4) будут иметь вид, как показано на следующем рисунке:
. Тогда процессы нагрева жидкости (1-2), парообразования (2-3) и перегрева пара (3-4) будут иметь вид, как показано на следующем рисунке:
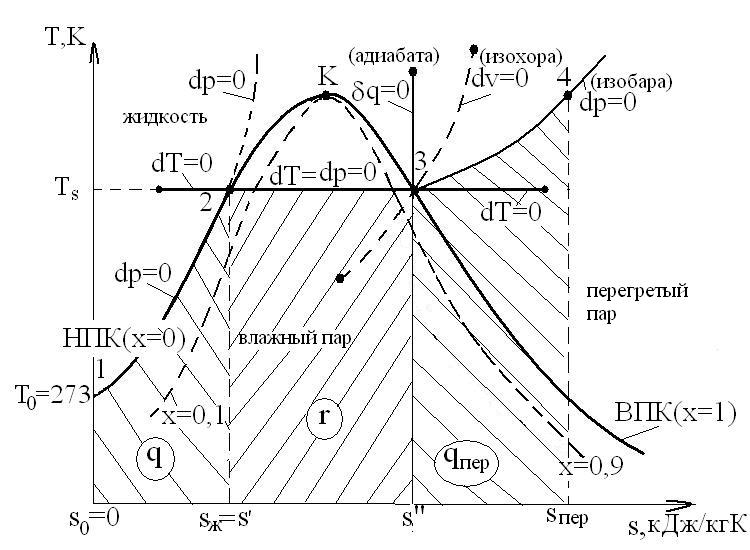
1. Процесс (1-2) нагрева жидкости при p=const. При этом изобара практически совпадает с НПК, так как термическая расширяемость жидкости мала.
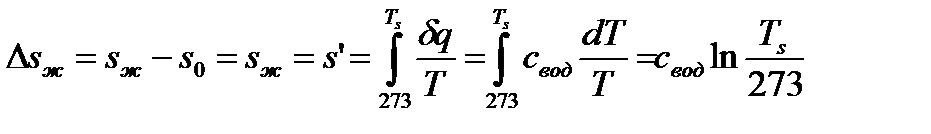 . (72)
. (72)
Таким образом:
 . (1) (73)
. (1) (73)
2. Процесс (2-3) парообразования при 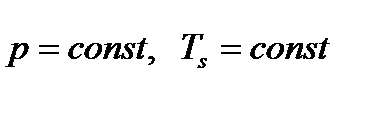 .
.
 или
или  . (74)
. (74)
Площадь под изотермой 2-3 равна теплоте парообразования r.
3. Процесс (3-4) – перегрев пара
 . (75)
. (75)
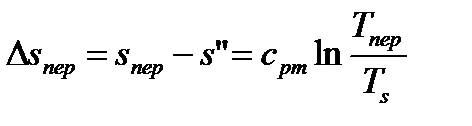 . ((76)
. ((76)
Не нашли, что искали? Воспользуйтесь поиском: