
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Отличия реальных газов и паров от идеальных. Процессы парообразования. pv-диаграмма водяного пара 3 страница
Энтропия влажного пара:
 . (77)
. (77)
Энтропия сухого насыщенного пара (х=1).
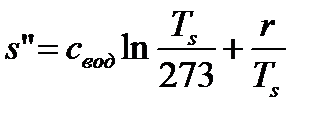 . (78)
. (78)
Энтропия перегретого пара:
 . (79)
. (79)
Изобара в области перегретого пара (3-4) идет более круто, чем изобара в области нагрева воды (1-2).
На паровой диаграмме «h-s» критическая точка «К» сдвинута влево и вниз по отношению к вершине, так как энтальпия «hк» в критической точке не является максимальной величиной. Так для воды 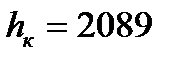 кДж/кг, а
кДж/кг, а  кДж/кг при давлении р=30-40 ата.
кДж/кг при давлении р=30-40 ата.
Как уже отмечалось, при построении диаграммы «h-s» принимается, что при температуре t0=00C величины энтальпии, внутренней энергии и энтропии равны нулю, т.е. 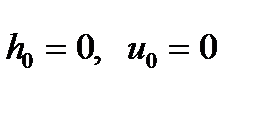 и
и 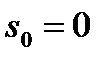 (см. диаграмму «h-s»).
(см. диаграмму «h-s»).

Процесс 1-2 – подогрев жидкости при  : теплота жидкости
: теплота жидкости 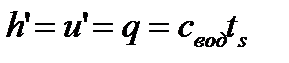 , энтропия
, энтропия 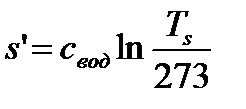 . (80)
. (80)
Процесс 2-3 – парообразование (прямая наклонная линия в области влажного пара):
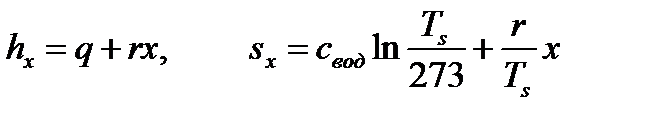 . (81)
. (81)
Для сухого насыщенного пара (т.3):
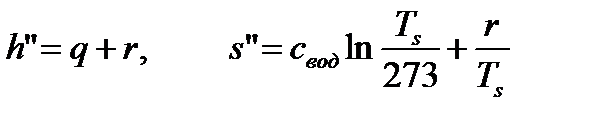 . (82)
. (82)
Для перегретого пара (т.4):
 , (83)
, (83)
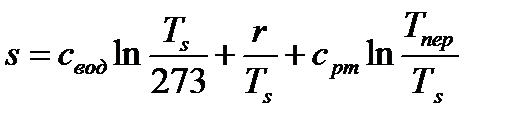 . (84)
. (84)
Положение точек на диаграмме «h-s» определяется заданием следующих параметров:
для влажного пара заданием давления (р) и степени сухости (х);
для сухого насыщенного пара (х=1) заданием давления (р);
для перегретого пара заданием давления (р) и температуры (Т).
По положению точки на диаграмме «h-s» можно определить все параметры этого состояния, рассчитать теплоту и внешнюю работу любого процесса. В диаграмме «h-s» теплоты выражаются прямыми линиями. Поэтому расчет паровых процессов в энергетической части более удобно проводить по диаграмме «h-s», чем по диаграмме «Т-s», где теплоты выражаются площадями под кривой процесса, которые надо измерять планиметром.
Расчет теплоты, работы и изменений внутренней энергии с помощью паровой диаграммы «h-s» проводится в следующем порядке:
- по условию задания наносят на диаграмму график процесса 1-2;
- по положению крайних точек процесса «1-2» определяют все параметры пара а начале: 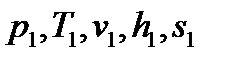 , и в конце:
, и в конце: 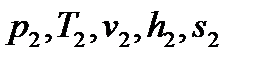 , процесса;
, процесса;
- по общей для всех процессов формуле определяется изменение внутренней энергии пара в процессе «1-2»:
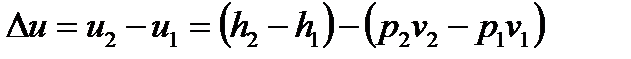 .
.
Для пара в изотермическом процессе величина 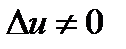 и
и 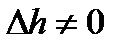 (как известно, для идеального газа в процессе T=const
(как известно, для идеального газа в процессе T=const 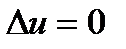 и
и 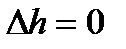 ). Это связано с тем, что в процессе парообразования внутренняя теплота испарения
). Это связано с тем, что в процессе парообразования внутренняя теплота испарения 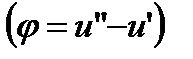 идет на преодоление внутреннего сцепления между молекулами (работу дисгрегации), которая зависит как от температуры, так и от давления;
идет на преодоление внутреннего сцепления между молекулами (работу дисгрегации), которая зависит как от температуры, так и от давления;
- определяется теплота, сообщенная пару в процессе «1-2»:
при 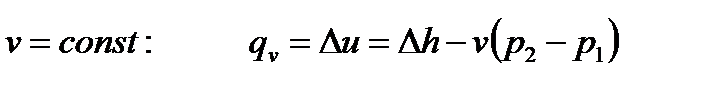 ;
;
при  ;
;
при 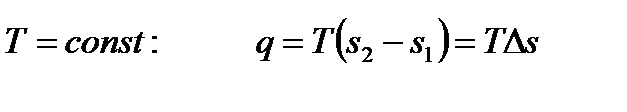 ;
;
при адиабатном процессе:  и
и 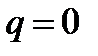 ;
;
- определяется внешняя работа пара по общему выражению 1-го закона термодинамики:  .
.
1.8.1. Основные уравнения процессов течения. Течение газа в каналах переменного сечения (АЗ: 2, СРС: 0,5)
Непрерывное течение газа рассматривается в термодинамике как равновесный процесс. Принимается, что течение – пространственно одномерное, т.е. параметры потока газа: давление р, температура Т, скорость w и плотность 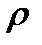 и др. изменяются только в направлении течения и, что течение - стационарное (установившиеся), т.е. параметры не изменяются во времени
и др. изменяются только в направлении течения и, что течение - стационарное (установившиеся), т.е. параметры не изменяются во времени 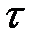 ; расход газа G=const(
; расход газа G=const( );
); 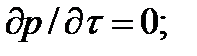
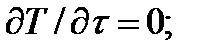

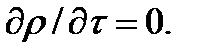
Принимается также, что течение - адиабатное, т.е. 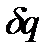 =0, изоэнтропийное, т.е. ds=0, что техническая работа не совершается
=0, изоэнтропийное, т.е. ds=0, что техническая работа не совершается  и что пьезометрическая высота не изменяется (dy=0).
и что пьезометрическая высота не изменяется (dy=0).
Для определения параметров потока (W, p, T,  ) в каждом поперечном сечении по длине канала fx решается при сделанных допущениях следующая система уравнений:
) в каждом поперечном сечении по длине канала fx решается при сделанных допущениях следующая система уравнений:
- уравнение энергии (уравнение 1-го закона термодинамики):
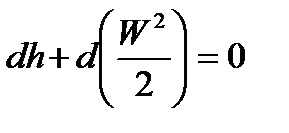 ; (85)
; (85)
- уравнение движения (Бернулли):
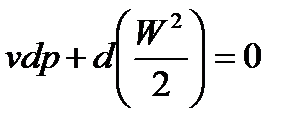 ; (86)
; (86)
- уравнение неразрывности (уравнение расхода):
 ; (87)
; (87)
- уравнение состояния для газа:
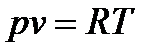 ,
,
и для несжимаемой жидкости: 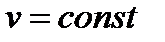 . (88)
. (88)
Уравнения энергии (85), Бернулли (86) и неразрывности (87) справедливы для жидкостей и газов. Запись уравнения состояния (88) определяет в каком состоянии: жидком или газообразном, находится ТС. Из сопоставления уравнений (85) и (86) следует, что
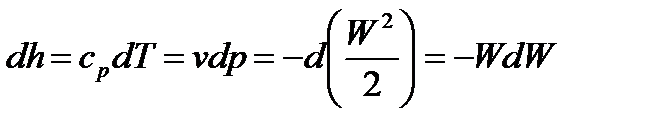 , (89)
, (89)
т.е. с ростом скорости W в адиабатном потоке газа его энтальпия h, температура Т и давление р уменьшаются.
Уравнение обращения воздействий отражает воздействие на параметры потока формы канала. Для его вывода рассмотрим стационарное течение в канале (G=const). Из уравнения расхода:
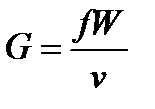 , или
, или 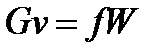 , (90)
, (90)
после его дифференцирования имеем:
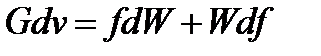 . (91)
. (91)
Разделим выражение (91) на уравнение (90) почленно.
Тогда имеем:
 , или
, или 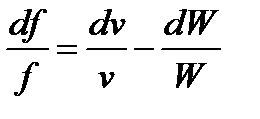 . (92)
. (92)
Из уравнения адиабатного процесса
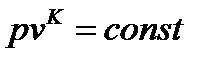 , (93)
, (93)
после дифференцирования получим:
 ,
,
или 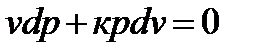 . (94)
. (94)
Разделим выражение (95) на 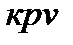 . Тогда:
. Тогда:
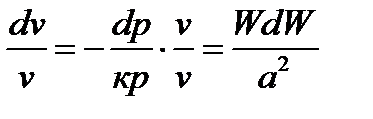 . (95)
. (95)
где  ; а – скорость звука, м/с; - vdp=WdW – уравнение Бернулли. После подстановки выражения (95) в уравнение (92) имеем:
; а – скорость звука, м/с; - vdp=WdW – уравнение Бернулли. После подстановки выражения (95) в уравнение (92) имеем:
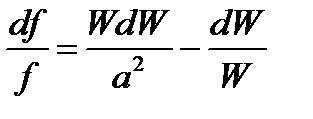 , (96)
, (96)
или

 , (97)
, (97)
где 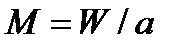 - число Маха. Правая часть уравнения обращения воздействий для адиабатного изоэнтропийного течения идеального газа (97) содержит основные параметры потока: число Маха и изменение скорости
- число Маха. Правая часть уравнения обращения воздействий для адиабатного изоэнтропийного течения идеального газа (97) содержит основные параметры потока: число Маха и изменение скорости 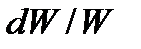 , а левая часть – отражает воздействие на течение среды изменения площади поперечного сечения канала df, т.е. формы канала.
, а левая часть – отражает воздействие на течение среды изменения площади поперечного сечения канала df, т.е. формы канала.
Рассмотрим воздействие формы канала df на адиабатное течение в соплах и диффузорах. Сопла – это каналы, в которых происходит расширение газа и увеличение скорости его движения. В диффузорах происходит сжатие газа и уменьшение скорости его движения.
Для течения в соплах, где газ расширяется и скорость растет dW>0. При этом знак df будет одинаковым со знаком скобки (М2-1) уравнения (97).
Если на входе в сопло число Маха M<1 и разность (М2-1) – отрицательна, то сопло является суживающимся, т.е. df<0.
Если на входе в сопло число Маха М>1, то разность (М2-1) – положительна и df>0, т.е. сопло – расширяющееся. Увеличение скорости течения при М>1 происходит за счет увеличения площади поперечного сечения канала.
В диффузорах, где происходит сжатие газа и уменьшение скорости его движения, dW<0 и знак df противоположен знаку выражения (М2-1). При M>1 df<0, т.е. диффузор суживающийся. При M<1 df>0, т.е. диффузор расширяющийся.
Таким образом, один и тот же канал в зависимости от величины скорости газа на входе в канал может работать и как диффузор и как сопло. В суживающемся сопле нельзя достичь скорости газа, большей, чем местная скорость звука. Для получения скорости истечения большей скорости звука должны применяться комбинированные сопла – сопла Лаваля.
Скорость адиабатного потока. Истечение газа из сосуда неограниченной емкости (АЗ: 2, СРС: 0,5)
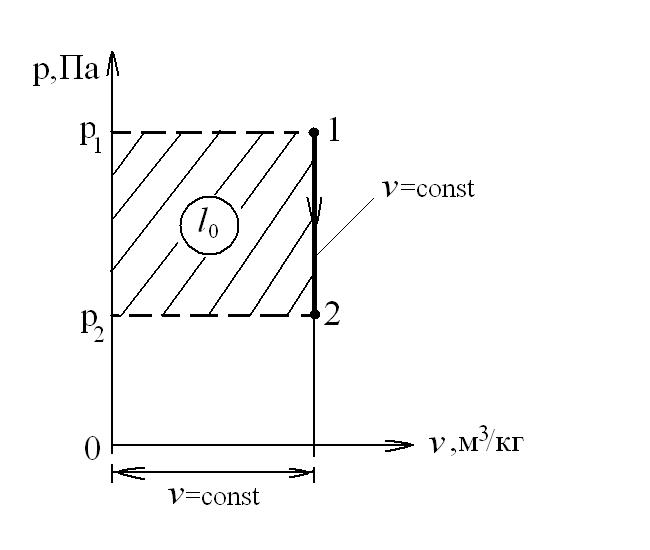
Рассмотрим истечение газа из сосуда неограниченной емкости. В этом случае параметры на входе в сопло равны параметрам торможения 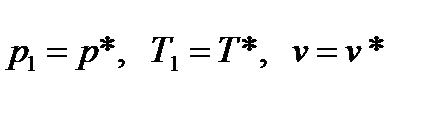 , а скорость W1=0. Скорость на выходе из сопла с площадью поперечного сечения f2 равна скорости истечения W2=W, а давление газа на выходе из сопла – давлению окружающей среды р2. Схема сопла представлена на следующем рисунке:
, а скорость W1=0. Скорость на выходе из сопла с площадью поперечного сечения f2 равна скорости истечения W2=W, а давление газа на выходе из сопла – давлению окружающей среды р2. Схема сопла представлена на следующем рисунке:

Располагаемая работа при адиабатном течении газа в сопле идет на увеличение кинетической энергии потока газа:
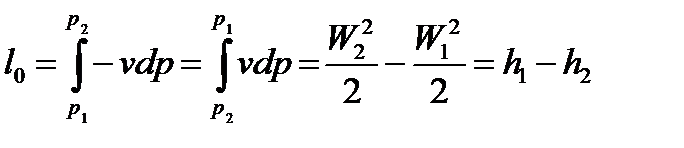 . (98)
. (98)
В p-v координатах располагаемая работа равна:
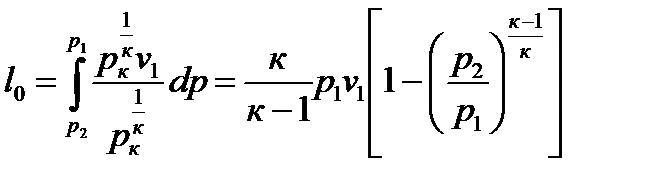 . (99)
. (99)
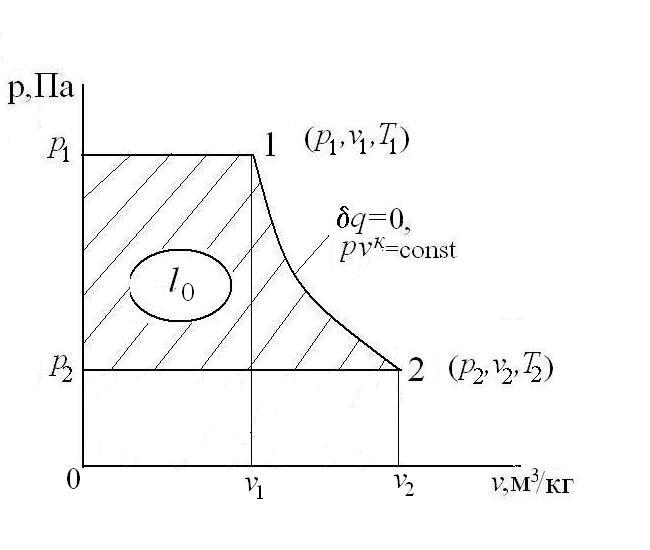
В h-s координатах: l0=h1-h2

В T-s координатах: 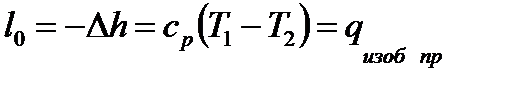
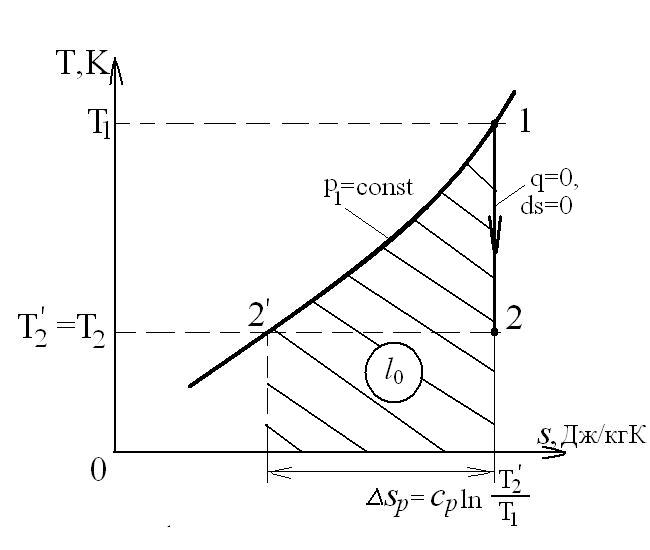
Располагаемая работа при течении в сопле несжимаемой жидкости (v=const) равна:
 . (100)
. (100)
Расчет скорости истечения газа
Скорость истечения газа определяется из выражения 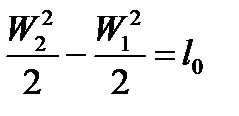 .
.
Тогда 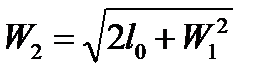 , при
, при 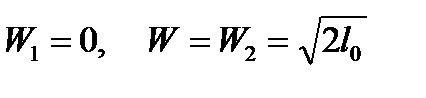 . (101)
. (101)
Тогда имеем: 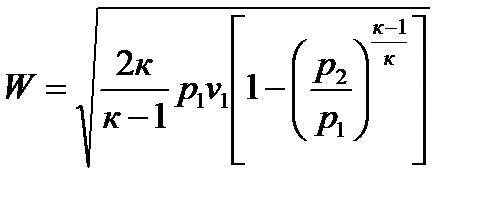 , м/с, или
, м/с, или
 , м/с. (102)
, м/с. (102)
Скорость истечения газа зависит от состояния газа на входе в сопло и глубины его расширения, т.е. от отношения давлений газа р2/р1.
Если выразить располагаемую работу через изменение энтальпий газа, то получим
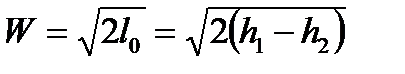 , м/с. (103)
, м/с. (103)
Таким образом, скорость истечения газа зависит от значений энтальпий газа перед соплом и на выходе из него.
Максимальная скорость истечения газа будет при его истечении в вакуум, т.е. при р2=0:
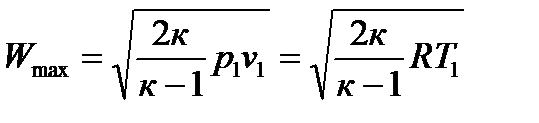 . (104)
. (104)
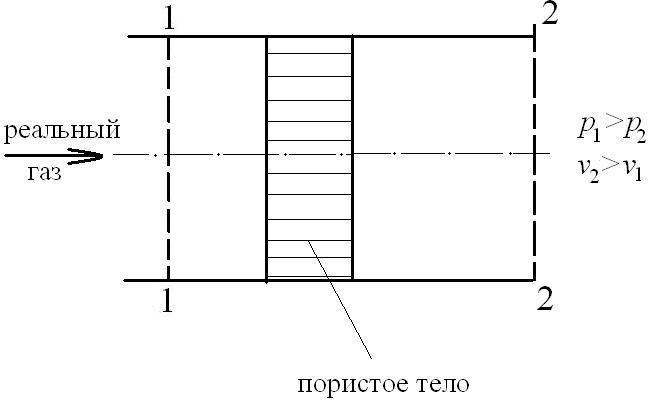
Дросселирование газов и паров. Кривые инверсии (АЗ: 2, СРС: 1)
Процесс течения газа или пара через местное гидравлическое сопротивление, например, диафрагму в трубопроводе при отсутствии теплообмена (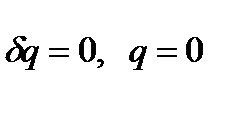 ) называется адиабатным дросселированием газа или пара. Этот процесс течения газа представлен на следующем рисунке:
) называется адиабатным дросселированием газа или пара. Этот процесс течения газа представлен на следующем рисунке:
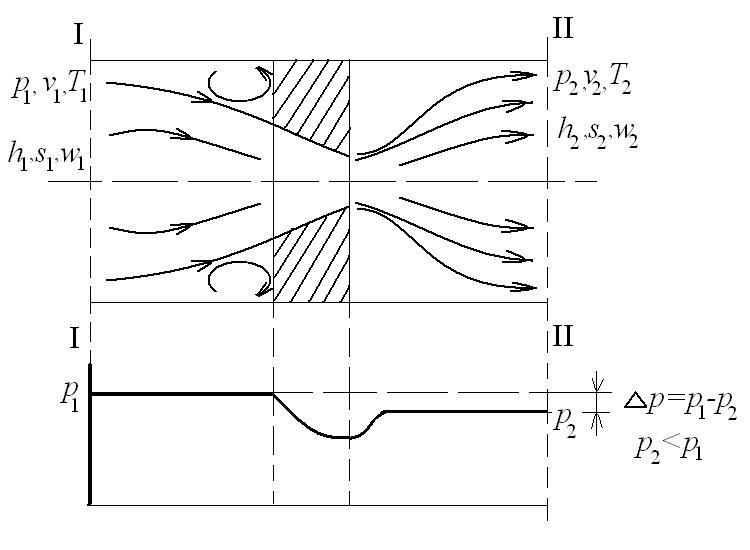
При дросселировании скорость газа в узком сечении диафрагмы увеличивается, а температура уменьшается. После прохождения диафрагмы скорость и температура в сечении II-II восстанавливаются. При этом скорость 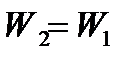 , а температура Т2 для идеального газа Т2=Т1 и для реальных газов и паров Т2
, а температура Т2 для идеального газа Т2=Т1 и для реальных газов и паров Т2  Т1. Тогда из уравнения 1-го закона термодинамики имеем изменение энтальпии при дросселировании:
Т1. Тогда из уравнения 1-го закона термодинамики имеем изменение энтальпии при дросселировании:
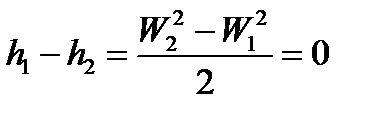 , т.е.
, т.е. 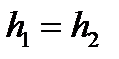 . (105)
. (105)
Таким образом, процесс дросселирования газа 1-2 является изоэнтальпийным (h=const), как показано на следующем рисунке:

В процессе 1-2 происходят необратимые явления (трение, вихреобразование) и энтропия растет: 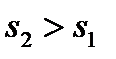 .
.
Из объединенного выражения 1-го и 2-го законов термодинамики: 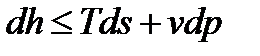 , при dh=0 имеем:
, при dh=0 имеем: 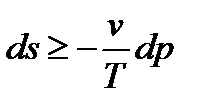 .
.
Поскольку 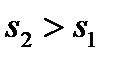 и
и 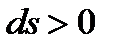 , то
, то 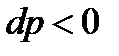 , т.е. давление при дросселировании газа может только уменьшаться, а его удельный объем – увеличиваться, т.е.
, т.е. давление при дросселировании газа может только уменьшаться, а его удельный объем – увеличиваться, т.е. 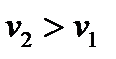 .
.
Величина потерь давления  в процессе дросселирования газа зависит от природы и состояния газа, а также от его скорости, относительного сужения канала и других параметров. Функция
в процессе дросселирования газа зависит от природы и состояния газа, а также от его скорости, относительного сужения канала и других параметров. Функция 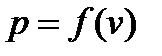 убывающая и ее производная при
убывающая и ее производная при  величина отрицательная, т.е.
величина отрицательная, т.е. 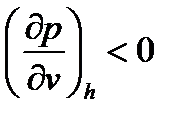 .
.
Таким образом, можно сделать вывод, что при дросселировании газа:  , а температура газа либо увеличивается, либо уменьшается, либо остается неизменной (для идеального газа и для точек инверсии в случае реального газа Т2=Т1).
, а температура газа либо увеличивается, либо уменьшается, либо остается неизменной (для идеального газа и для точек инверсии в случае реального газа Т2=Т1).
Эффект Джоуля-Томсона – это явление изменения температуры газа при адиабатном дросселировании, когда происходит расширение газа без совершения внешней работы и без теплообмена за счет преодоления гидравлического сопротивления 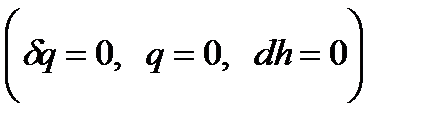 . При этом затрачивается работа проталкивания
. При этом затрачивается работа проталкивания  :
:
Эффект Джоуля-Томсона принято называть положительным, если газ в процессе дросселирования охлаждается (ΔТ < 0), и отрицательным, если газ нагревается (ΔТ > 0).
Согласно молекулярно-кинетической теории строения вещества, Эффект Джоуля-Томсона свидетельствует о наличии в газе сил межмолекулярного взаимодействия (обнаружение этих сил было целью опытов Джоуля и Томсона). Действительно, при взаимном притяжении молекул внутренняя энергия (U) газа включает как кинетическую энергию молекул, так и потенциальную энергию их взаимодействия. Расширение газа в условиях энергетической изоляции не меняет его внутренней энергии, но приводит к росту потенциальной энергии взаимодействия молекул (поскольку расстояния между ними увеличиваются) за счёт кинетической. В результате тепловое движение молекул замедлится, температура расширяющегося газа будет понижаться. В действительности процессы, приводящие к Эффекту Джоуля-Томсона, сложнее, т.к. газ не изолирован энергетически от внешней среды. Он совершает внешнюю работу (последующие порции газа, справа от дросселя, теснят предыдущие), а слева от дросселя над самим газом совершают работу силы внешнего давления (поддерживающие стационарность потока). Это учитывается при составлении энергетического баланса в опытах Джоуля — Томсона.
Получим дифференциальное уравнение эффекта Джоуля-Томсона. Для этого запишем функцию состояния - энтальпию в виде:  .
.
Ее дифференциал – полный дифференциал, равный:
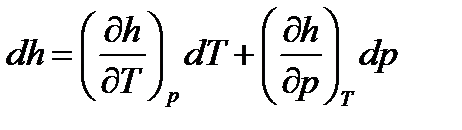 . (106)
. (106)
Удельная теплоемкость при p=const по определению равна:
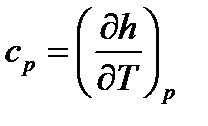 . (107)
. (107)
Производную 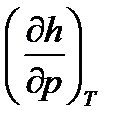 , входящую в (1), получим из объединенного выражения 1-го и 2-го законов термодинамики:
, входящую в (1), получим из объединенного выражения 1-го и 2-го законов термодинамики:
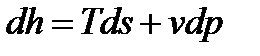 . (108)
. (108)
Разделим уравнение (108) на величину dp при Т=const.
Тогда получим уравнение 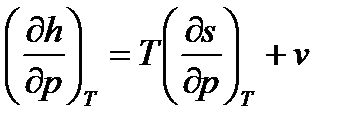 , в котором заменим
, в котором заменим 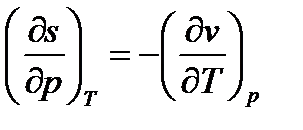 , используя уравнения Максвелла (дифференциальные соотношения взаимности). Тогда получим:
, используя уравнения Максвелла (дифференциальные соотношения взаимности). Тогда получим:
 . (109)
. (109)
Подставим в уравнение (106) значения производных 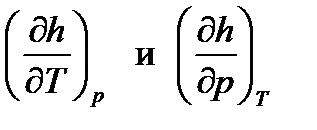 из выражений (107) и (109), учитывая, что dh=0:
из выражений (107) и (109), учитывая, что dh=0:
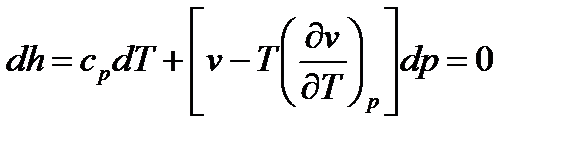 , (110)
, (110)
или при h=const:
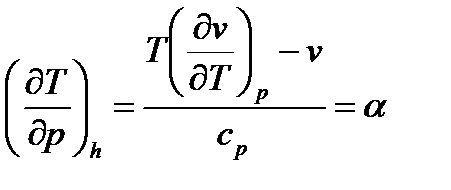 . (111)
. (111)
Уравнение (111) является дифференциальным уравнением эффекта Джоуля-Томсона, которое позволяет определить характер изменения температуры в процессе дросселирования. В уравнении (111) величина  называется дифференциальным температурным коэффициентом дросселирования. Для определения величины
называется дифференциальным температурным коэффициентом дросселирования. Для определения величины 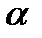 требуется знать термическое уравнение состояния и теплоемкость ср для данного вещества.
требуется знать термическое уравнение состояния и теплоемкость ср для данного вещества.
Поскольку величина dp отрицательна 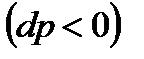 , то знак величины dT в уравнении (111) противоположен знаку числителя этого уравнения. Для идеального газа термическое уравнение состояния: pv=RT. Тогда производная
, то знак величины dT в уравнении (111) противоположен знаку числителя этого уравнения. Для идеального газа термическое уравнение состояния: pv=RT. Тогда производная 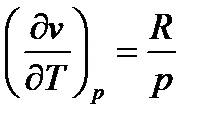 и числитель уравнения (111) равен
и числитель уравнения (111) равен 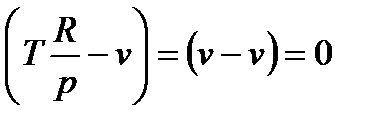 , т.е. коэффициент
, т.е. коэффициент 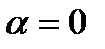 . Для реальных газов и паров возможны три случая в зависимости от начального состояния газа перед дросселированием:
. Для реальных газов и паров возможны три случая в зависимости от начального состояния газа перед дросселированием:
1. 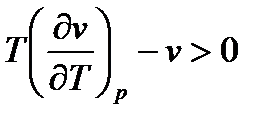 . Тогда
. Тогда 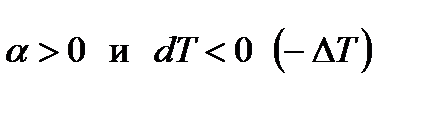 ;
;
2. 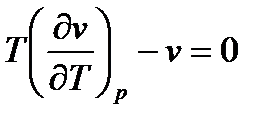 . Тогда
. Тогда 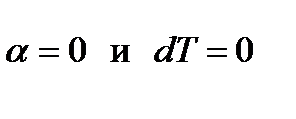 - уравнение инверсии;
- уравнение инверсии;
3. 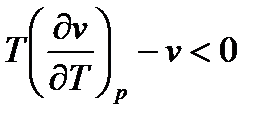 . Тогда
. Тогда 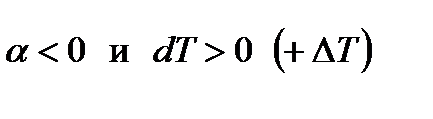 .
.
Точка, в которой dT=0, есть точка инверсии (перестановки). Температура Т2=Т1=Тинв – температура инверсии. В критической точке для всех веществ 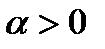 и
и 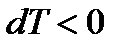 , т.е. реализуется 1-ый случай. Проиллюстрируем эти случаи дросселирования с помощью паровой диаграммы T-v для изобары (p=const):
, т.е. реализуется 1-ый случай. Проиллюстрируем эти случаи дросселирования с помощью паровой диаграммы T-v для изобары (p=const):

где х – степень сухости пара; tg 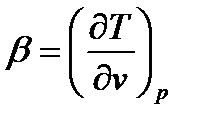 .
.
1-ый случай: Если начальное состояние вещества перед дросселированием определяется точкой А, то отрезок на графике MN= 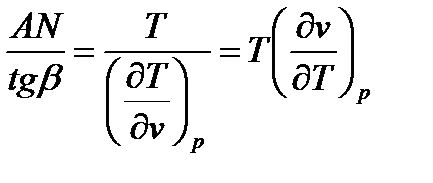 является первым слагаемым числителя выражения (6), а отрезок МО=MN-ON=
является первым слагаемым числителя выражения (6), а отрезок МО=MN-ON= 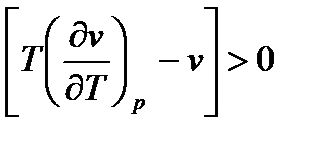 является числителем выражения (6), так как MN>ON.
является числителем выражения (6), так как MN>ON.
Таким образом, для этого случая  и
и  , т.е. газ при дросселировании охлаждается.
, т.е. газ при дросселировании охлаждается.
2-ой случай: Если начальное состояние перед дросселированием определяется точкой В, то отрезок M1N1<ON1 и М1О=M1N1-ON1  .
.
Тогда, согласно уравнению (6), 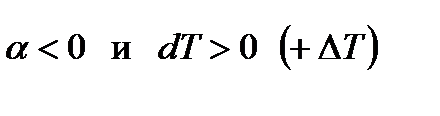 и газ при дросселировании нагревается.
и газ при дросселировании нагревается.
3-ий случай: Если начальное состояние вещества перед дросселированием определяется точками С1 и С2,то отрезок М20=0 и согласно уравнению (6), 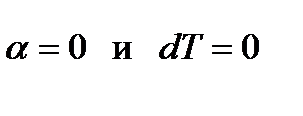 , т.е. температура газа не изменяется при дросселировании (точка М2 совпадает с началом координат). Точки С1 и С2 – точки инверсии. Для любой изобары реального газа имеются две точки инверсии С1 и С2, где С1 – в области жидкости и С2 – в области перегретого пара.
, т.е. температура газа не изменяется при дросселировании (точка М2 совпадает с началом координат). Точки С1 и С2 – точки инверсии. Для любой изобары реального газа имеются две точки инверсии С1 и С2, где С1 – в области жидкости и С2 – в области перегретого пара.
Реальный газ или пар можно путем дросселирования перевести в жидкое состояние в том случае, если его начальная температура перед дросселированием будет меньше температуры инверсии Тинв2. Положительный эффект Джоуля-Томсона используется в холодильной технике для получения холода.
Для идеального газа, молекулы которого рассматриваются как материальные точки, не взаимодействующие между собой, Эффект Джоуля-Томсона равен нулю.
Величина 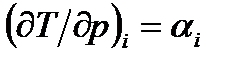 - интегральный Эффект Джоуля-Томсона, определяющий изменение температуры при бесконечно малом падении давления в процессе дросселировании.
- интегральный Эффект Джоуля-Томсона, определяющий изменение температуры при бесконечно малом падении давления в процессе дросселировании.
Выражение
 (112)
(112)
определяет так называемый интегральный Эффект Джоуля-Томсона (изменение температуры при конечной разности давлений).
Очевидно, что для увеличения интегрального Эффекта Джоуля-Томсона начальную температуру процесса дросселирования нужно понижать.
В зависимости от условий дросселирования один и тот же газ может как нагреваться, так и охлаждаться. Температура, при которой (для данного давления) разность ΔT, проходя через нулевое значение, меняет свой знак, называется температурой инверсии Эффекта Джоуля-Томсона.
При больших перепадах давления на дросселе температура газа может изменяться значительно. Например, при дросселировании от 200 до 1 атмосферы и начальной температуре 17°С воздух охлаждается на 35°С. Этот интегральный эффект положен в основу большинства технических процессов сжижения газов.
2.3.1. Способы задания смесей. Соотношения между массовыми и молярными долями. Определение основных характеристик для смесей. (АЗ: 2, СРС: 1)
Для проведения термодинамических расчетов систем с газовыми смесями или растворами необходимо знать их состав. Состав смеси может быть задан:
- массовыми долями 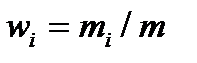 , где
, где  , где
, где  - молярная масса i-го компонента, кг/моль,
- молярная масса i-го компонента, кг/моль,  - относительная молекулярная масса i-го компонента,
- относительная молекулярная масса i-го компонента, 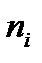 - количество i-го компонента, моль;
- количество i-го компонента, моль;
- молярными долями 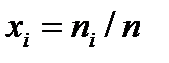 , где
, где 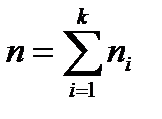 , - количество вещества смеси, моль;
, - количество вещества смеси, моль;
- объемными долями, которые равны молярным долям  .
.
Состав смеси идеальных газов может быть также задан парциальными давлениями pi, массовыми концентрациями ρ и молярными концентрациями 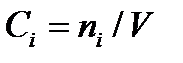 .
.
Парциальное давление pi – это давление i-го компонента газовой смеси при условии, что он занимает весь объем, предназначенный для смеси, при температуре смеси.
На рисунке ниже представлена диаграмма температура – концентрация для двухкомпонентной смеси. По оси абсцисс обычно откладывается концентрация низкокипящего компонента xi (НКК), а по оси ординат температуры низкокипящего компонента (НКК), высококипящего компонента (ВКК) и температуры смеси. Сумма концентраций низкокипящего и высококипящего компонентов в жидкости и паре подчиняется очевидным равенствам
Не нашли, что искали? Воспользуйтесь поиском: