
- Р Р‡.МессенРТвЂВВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВВнокласснРСвЂВВВВВВВВВРєРСвЂВВВВВВВВВ
- Telegram
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВВРЎР‚
- Skype
- LiveJournal
- Blogger
- РЎРєРѕРїРСвЂВВВВВВВВВровать ссылку
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электронные формулы атомов. Периодическая система элементов
Распределение электронов в атоме по энергетическим уровням и подуровням, в соответствии с вышеуказанными принципами и правилами, изображают в виде электронных формул, общий вид которых nl x, где
n –главное квантовое число;
l – орбитальное квантовое число обозначается символом
(s, p, d, f);
x – число электронов.
Рассмотрим периодическую систему.
Первый период. Атом водорода имеет единственный электрон, который занимает в нормальном состоянии уровень с самой маленькой энергией – 1s (n = 1 l = 0, m = 0); у гелия второй электрон располагается на этом же уровне и имеет противоположный спин.
 |
Второй период. В атомах лития три электрона. Для их размещения одного первого энергетического уровня не хватает. Максимальное число электронов на 1s-орбитали – два (принцип Паули). Начинается застройка следующего (второго) энергетического уровня, в котором низшая по энергии орбиталь – 2s (n =1, l = 0, m = 0).
   |
Далее следует набор из трех энергетически равноценных 2p-орбиталей (n = 2 l = 1, m = -1, 0, +1) и поэтому пятый электрон бора занимает вакантную 2p-орбиталь. Электронное строение бора:
B: 1s22s22p1.
В атомах углерода и азота электроны займут 2p-орбитали в соответствии с правилом Хунда. Каждый электрон займет отдельную орбиталь и все они будут иметь параллельные спины.
   |
Ne: 1s22s22p6
Третий период. В атомах третьего периода последние электроны располагаются на третьем слое, последовательно заполняя s- и p-подуровни.




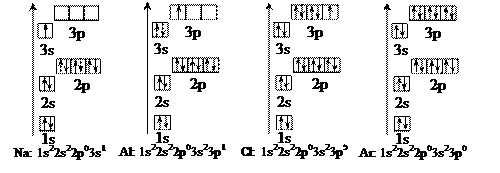
III период заканчивается, но остается незавершенным третий энергетический уровень (3d-подуровень свободен).
Четвертый период. В атоме калия последний электрон попадает не на 3d-подуровень, а на обладающий более низкой энергией 4s-подуровень (таб. 2)
Сравним суммы (n + l) этих двух подуровней. Подуровню 4s отвечает сумма (n + l), равная 4 + 0 = 4, а у подуровня 3d сумма (n + l) равна 3 + 2 = 5. Это означает, что энергия 4s – подуровня ниже энергии 3d – подуровня. Именно поэтому на эту орбиталь и отправляется электрон. Электронное строение атома калия выражается формулой: 1s22s22p63s23p64s1. У кальция 4s – подуровень заполнен двумя электронами: 1s22s22p63s23p64s2.
После подуровня 4s в четвертом энергетическом уровне следует 4р – подуровень, но следует еще помнить о наличии незаполненного 3d – подуровня третьего энергетического уровня. Для разрешения альтернативы рассчитаем сумму (n + l) конкурирующих подуровней.
Подуровню 4р отвечает сумма (n + l), равная 4 + 1 = 5. Подуровню 3d отвечает сумма (n + l), равная 3 + 2 = 5. При равенстве сумм, в соответствии со вторым правилом Клечковского сопоставляем значения главных квантовых чисел, которое у 3d – подуровня меньше (чем у 4р), и поэтому электроны заполняют вначале 3d – подуровень, и только потом 4р. Пять орбиталей 3d – подуровня могут быть заняты десятью электронами, что и реализуется для десяти атомов химических элементов, начиная от скандия до цинка. Электронное строение скандия соответствует формуле: 1s22s22p63s23p64s23d1, а цинка - 1s22s22p63s23p64s23d10. У последующих (за цинком) элементов вплоть до инертного газа криптона идет заполнение 4р – подуровня. В IV периоде 18 элементов.
У элементов V периода заполнение электронами уровней и подуровней осуществляется по аналогии, как и в IV периоде. У рубидия и стронция 5s – состояние оказывается более выгодным, чем 4d – состояние. Заполнение 4d – подуровня начинается с иттрия и завершается у кадмия, после чего электроны занимают 5р – подуровень. В V периоде, как и в IV, 18 элементов.
Шестой период, как и все предыдущие, начинается с двух s – элементов (цезий и барий), у которых завершается заполнение орбиталей с суммой (n + l) = 6. В последующем, согласно правила Клечковского, заполняется подуровень с суммой (n + l) = 7. Однако значение такой суммы характерно для трех подуровней:
4f (n + l) = 4 + 3 = 7;
5d (n + l) = 5 + 2 = 7;
6p (n + l) = 5 + 2 = 7.
В этой связи с учетом второго правила Клечковского, первым должен заполняться 4f – подуровень, как обладающий наименьшим значением главного квантового числа, затем 5d и после его завершения, осуществляется заполнение 6p – подуровня.
На самом же деле у лантана, расположенного непосредственно после бария, заполняется не 4f, а 5d – подуровень, так, что его электронная структура соответствует формуле: 1s22s22p63s23p64s23d104p65s24d105p66s25d1. Однако уже у следующего за лантаном элемента церия действительно начинается застройка подуровня 4f, на который переходит и единственный 5d – электрон, имевшийся в атоме лантана; в соответствии с этим, электронная структура атома церия выражается формулой:
1s22s22p63s23p64s23d104p65s24d105p66s25f2
Таким образом, имеющееся отступление от второго правила Клечковского распространяется только на лантан, но начиная с церия, происходит последовательное, в рамках правил, заполнение всех орбиталей 4f – подуровня. Эти элементы называются лантаноидами, т.к. они близки по свойствам к лантану.
Заполнение 5d – подуровня, начатое у лантана, возобновляется у гафния и заканчивается у ртути. Затем происходит заполнение 6р – подуровня. Оно начинается у таллия и заканчивается у благородного газа радона, которым и завершается шестой период. В VI периоде 32 элемента.
Седьмой период, пока еще окончательно не скомплектован (до полного завершения) элементами. Последовательность заполнения такова же, как у элементов шестого периода, начинается с 7s – подуровня у франция и радия. Актиний начинает группу 6d – элементов (актиноиды), после которого начинает заполняться 5f – подуровень 14 электронами. После 103-го элемента идет заполнение 6d – подуровня: у курчатовия и нильсбория.
В зависимости от того, какой подуровень заполняется электронами последним, все элементы подразделяют на четыре типа (семейства):
1. s – элементы; заполняется электронами S – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода;
2. p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние 6 элементов каждого периода, кроме I и VII;
3. d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне остается один или два электрона. К ним относятся элементы вставных декад больших периодов, расположенных между s и p – элементами;
4. f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается один или два электрона. Это лантаноиды и актиноиды.
Не нашли, что искали? Воспользуйтесь поиском: