
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Влияние температуры на скорость реакций. Катализ
Влияние температуры на скорость химической реакции согласуется с правилом Вант-Гоффа: при повышении температуры на каждые 10 оС скорость реакции увеличивается в 2-4 раза. Уравнение Вант-Гоффа имеет вид:
| t1 – t2 | (20) | ||
| ut2 = ut2 · γ, | |||
где, ut2 и ut2 – скорости реакции соответственно при температурах t2 и t1;
γ – температурный коэффициент реакции (или коэффициент Вант-Гоффа), показывающий, во сколько раз увеличится скорость реакции при изменении температуры на каждые 10оС.
Влияние температуры на скорость химической реакции объясняет теория активных столкновений и активированного комплекса. Согласно первой, образование новых веществ происходит не при каждом столкновении реагирующих молекул: реагируют только те молекулы (они называются активными), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных частицах и тем самым создать возможность образования новых молекул. Для каждой стационарной химической системы характерно наличие определенного энергетического барьера (см. рисунок ниже). Для его преодоления необходима энергия активации Еа.
Энергия активации – некоторая избыточная (по сравнению со средней энергией молекул при данной температуре) энергия, которой должны обладать молекулы для того, чтобы их столкновение приводило к образованию новых веществ.
При небольших температурах только сравнительно небольшая часть молекул имеет энергию выше энергии активации и как следствие, способны вступить в реакцию. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому увеличению скорости реакции. Энергия активации Ea зависит от природы реагирующих веществ и служит характеристикой каждой реакции.
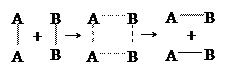 А2 + В2 = 2АВ
А2 + В2 = 2АВ
  |
Рис 8 Энергитический профиль эндотермической реакции
Как следует из рисунка, разность энергий конечного состояния системы и начального равна тепловому эффекту реакции DH.
Зависимость константы скорости реакции (k) от температуры (Т)выражается уравнением Аррениуса:
| - Ea | (21) | ||
| k = A · e, | RT | ||
где, А – коэффициент пропорциональности;
Ea - энергия активации;
e – основание натуральных логарифмов;
R – универсальная газовая постоянная.
Из уравнения следует, что при постоянной температуре константа скорости определяется энергией активации. Чем выше численное значение энергии активации, тем меньше число эффективных соударений и тем, следовательно, ниже константа скорости и скорость химической реакции.
Влияние катализатора.
Катализаторами называются вещества, участвующие в химическом процессе, изменяющие его скорость, но не входящие в состав продуктов реакции, т.е. к концу реакции остающиеся химически неизменными.
Не нашли, что искали? Воспользуйтесь поиском: