
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электролиты и неэлектролиты.
Электролитами называются вещества, распадающиеся на ионы в растворах и поэтому проводящие электрический ток. Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду и называются катионами (Na1,Mg2, Al3,) отрицательно заряженные - к аноду и называются анионами
(NO 3 , Cl, SO42,)
Диссоциация – обратимый процесс, т.е. параллельно с распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
Пример:


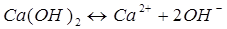
Вещества, не распадающиеся в растворах на ионы и не проводящие электрический ток, называются неэлектролитами (нефть, бензин, керосин, мазут, спирты, раствор сахара и т.д.).
По степени диссоциации различают сильные и слабые электролиты. Значения величин степени диссоциации некоторых электролитов приведены в табл. 3 приложения. Степень диссоциации а- это отношение числа распавшихся на ионы молекул n к общему числу растворенных молекул N: а=nlN
Степень диссоциации определяется опытным путем по величине электропроводности электролита и выражается в долях единицы или в процентах. Например, если a=20%, то это значит, что из 100 молекул данного электролита 20 молекул распалось на ионы. Если a=0, то диссоциация отсутствует; если a=1, то электролит полностью диссоциирует на ионы.
В зависимости от степени диссоциации все электролиты условно делятся на сильные (a>0,3), средние (0,03<a<0,3) и слабые (a<0,03). Степень диссоциации зависит от природе электролита, концентрации раствора и температуры. Так, по закону разбавления Оствальда, с уменьшением концентрации электролита, т.е. при его разбавлении водой, степень диссоциации всегда увеличивается.
Не нашли, что искали? Воспользуйтесь поиском: