
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тема 4. Окислительно-восстановительные и электрохимические процессы.
Электрохимические процессы. Равновесие на границе металл-раствор. Электродный потенциал. Уравнение Нернста. Водородный электрод. Ряд напряжений. Гальванический элемент. Электродвижущая сила.
Основные понятия электрохимии.
Часть химии, изучающая взаимосвязь между химическими и электрическими явлениями. Делиться на две части:
Теоретическая электрохимия
Изучает процесс на границе раздела, металл-электролит.
Прикладная электрохимия
Изучает вопросы:
– Создание химических источников тока.
– Создание водородного топлива.
– Вопросы гальвано пластики.
– Рафинирование металлов.
Особенности окислительно-восстановительных реакции в электрохимической системе.
1. Помимо обычного теплового эффекта, реакция в электрохимической системе сопровождается проявлением электрического тока.
2. Процессы окисления и восстановления в электрохимической системе разделены в пространстве.
3. Передача электронов от восстановителя к окислителю строго направлена.
4. Процессы на границе раздела металл-электролит- равновесные.
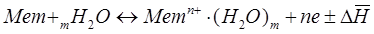
Электрохимические системы
1. Гальванический элемент – это система, в которой в результате ОВР образуется электрический ток.
2. Электролитическая система (электролиз) – это система, в которой
происходят окислительно-восстановительные реакции (ОВР) под действием постоянного тока, приложенного из вне.
Для составления той и другой системы необходимо:
– Электролит
– Электроды
– Проводники 1 рода.
Электролитом может быть раствор, расплав. Электроды – металлы, неметаллы (прессованный уголь).
Электрод, на котором имеет процесс восстановления, называется катодом, а окисления – анодом.
В гальваническом элементе:
Анод – отрицательный электрод, катод – положительный.
Анод – положительный электрод, катод – отрицательный.
Гальванический элемент.
Рассмотрим простой пример. Опустим цинковую пластину в раствор сульфата меди. Через некоторое время цинковая пластина покроется налётом красноватой меди. Прошла обычная окислительно-восстановительная реакция:

Не нашли, что искали? Воспользуйтесь поиском: