
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Фотометричний метод аналізу
Електромагнітне випромінювання являє собою вид енергії, що поширюється з величезною швидкістю. Найбільш розпізнаваною її формою є світло. Менш відомими являються рентгенівське, ультрафіолетове і радіовипромінювання. На електромагнітне випромінювання реагують усі хімічні сполуки, при цьому спостерігається зменшення інтенсивності потоку випромінювання, що пов'язане з витратою енергії на збудження електронів чи атомів у молекулах.
Явище, яке базується на вимірюванні зменшення (чи ослаблення) інтенсивності електромагнітного випромінювання, при проходженні його через речовину яка аналізується, використане в абсорбційній спектроскопії, одному з найважливіших методів аналітичної хімії.
Абсорбційна спектроскопія в близькому ультрафіолеті (200-400 нм.), видимій (400-760 нм.) близькій інфрачервоної області (760-1100 нм.) є основою спектрофотометричного і фотометричного методів аналізу, які використовуються для кількісного визначення. Методи мають велике значення для вивчення кінетики реакції, властивостей і будови сполук, визначення констант стійкості комплексних сполук речовин.
Фотометричний метод кількісного аналізу заснований на переведенні компонента, що визначається, в сполуку, яка поглинає видиме світло (400-760нм.) і вимірюванні світлопоглинання приготованого розчину. Цей метод характеризується високою чутливістю і достатньою вибірковістю. Час, що витрачається на аналіз, чутливість методу, його точність і вибірковість залежать від вибору хімічної реакції та утворення забарвленої сполуки. Вимірювання світлопоглинання можливе як візуальним порівнянням (колориметрія) так і інструментальними методами (фотометрія, спектрофотометрія).
Внаслідок поглинання випромінювання при проходженні його через шар речовини, інтенсивність випромінювання зменшується тим більше, чим вища концентрація світлопоглинаючої речовини і більша товщина шару.
Між кількістю поглинутої світлової енергії, товщиною шару поглинаючої речовини і його кількістю існує залежність, що виражається основним законом світлопоглинання - законом Бугера-Ламберта-Бера:
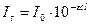 чи
чи 
It – інтенсивність ослабленого поглинанням світлового потоку, що пройшов крізь розчин, який аналізують;
Іо - інтенсивність падаючого світлового потоку;
ε - молярний коефіцієнт поглинання;
l - товщина світлопоглинаючого шару (см);
с - концентрація розчину (моль/л);
А - оптична густина розчину.
Фізичний зміст є стає зрозумілим, якщо прийняти l=1 см, с=1 моль/л, тоді А=Ε. Отже, молярний коефіцієнт поглинання дорівнює оптичній густині одномолярного розчину при товщині шару 1 см. Відповідно до цього закону -оптична густина прямо пропорційна кількості речовини і товщині поглинаючого шару. Зменшення інтенсивності світла, яке пройшло через розчин, характеризується також коефіцієнтом пропускання (чи просто пропусканням) Т =It/I0. Оптична густина А і пропускання Т пов'язані між собою співвідношенням:  Якщо в розчині декілька світлопоглинаючих компонентів, що не вступають один з одним у хімічну реакцію, то за умови дотримання закону Бугера-Ламберта-Бера, оптична густина такого розчину буде дорівнювати сумі парційних оптичних густин усіх світлопоглинаючих компонентів, які знаходяться у розчині. В цьому проявляється принцип (або правило) аддитивності оптичних густин.
Якщо в розчині декілька світлопоглинаючих компонентів, що не вступають один з одним у хімічну реакцію, то за умови дотримання закону Бугера-Ламберта-Бера, оптична густина такого розчину буде дорівнювати сумі парційних оптичних густин усіх світлопоглинаючих компонентів, які знаходяться у розчині. В цьому проявляється принцип (або правило) аддитивності оптичних густин.

На використанні принципу аддитивності засновані всі кількісні методи спектрофотометричного аналізу багатокомпонентних систем.
Методи кількісного аналізу засновані на застосуванні закону Бугера-Ламберта-Бера. Основними параметрами фотометричного визначення є довжина хвилі, оптична густина, товщина кювети і концентрація забарвленого розчину. Істотно впливають на світлопоглинання різні хімічні фактори, зв'язані з повнотою й умовами протікання фотометричної реакції, концентрацією забарвлених сполук, їх стійкістю, температурою, рН розчину, природою розчинника й інших факторів.
Прилади для вимірювання пропускання і поглинання розчинів складаються з п'яти основних вузлів (рис. 12):
1. Стабільного джерела випромінювання енергії (детектор), у спектрофотометрі їх два;
2. Пристрою, що дозволяє виділити певну область довжин хвиль (диспергатор);
3. Прозорих кювет для проби і розчинника (у спектрофотометрії застосовуються кварцові кювети);
4. Детектора або перетворювача, що перетворює променеву енергію в електричну;
5. Індикатора сигналу - реєстратора із градуйованою шкалою.

Рис.12 Основні вузли приборів в абсорбційній спектроскопії
Шкала індикатора безпосередньо показує пропускання у відсотках при попереднім настроюванні індикатора на нуль з закритою шторкою. Прилад настроюють на значення Т=100%, розмістивши на шляху світлового потоку холостий розчин (розчин порівняння). Якщо на шляху світлового потоку помістити кювету з випробуваним розчином, індикатор вкаже його світлопропускання (Т) у відсотках. Індикатор має також логарифмічну шкалу, з допомогою якої визначають безпосередньо оптичну густину, значення якої і записують.
Найбільш розповсюдженим джерелом випромінювання у фотометрах для одержання видимого світла є лампа з вольфрамовою ниткою. Джерела такого роду при нагріванні до білого розжарювання випускають безперервний спектр випромінювання, який залежить від робочої напруги і температури поверхні.
Після джерела випромінювання на шляху променів, що здобувають рівнобіжний напрямок завдяки конденсорним лінзам, знаходяться світлофільтри чи призми-диспергатори (у спектрофотометрії), що дозволяють з загального потоку виділити і направити на кювети більш вузький інтервал довжин хвиль, які максимально поглинаються забарвленим розчином. Оскільки електромагнітна енергія передається атомам чи молекулам речовини шляхом переводу атомів з нормального стану в збуджений, то поглинання їх відноситься до чітко вибіркового процесу. Розчином, у залежності від природи речовини, поглинається лише певна область довжин хвиль. Залежність А від довжини хвилі називається спектром поглинання забарвленої сполуки (рис. 10 кр. 1).
Для перетворення енергії випромінювання, Іо і її в електричну, з метою подальшої реєстрації їхнього співвідношення, тобто виміру А і Т, використовують фотоелементи різних типів:
Фотоелементи з замикаючим шаром, або вентильні, складаються з плоского залізного або мідного електрода, на який нанесений шар напівпровідникового матеріалу, наприклад селену чи оксиду міді (I). Поверхня напівпровідника покрита прозорою плівкою з золота, срібла чи свинцю, що служить другим, або уловлюючим електродом. При освітленні деякі електрони в шарові напівпровідника здобувають енергію і проникають у металеву плівку, з'єднану з зовнішнім ланцюгом. При цьому виникає електричний струм. Сила струму пропорційна інтенсивності випромінювання, що падає на фотоелемент. Перевагами фотоелементів із замикаючим шаром є висока чутливість, широкий спектральний інтервал і простота конструкції.
При зовнішньому фотоефекті поглинання світла приводить до відриву електронів з поверхні, що опромінюється, (як правило киснево-цезієвий або сурм'яно-цезієвий катод), які, потрапляючи на анод, замикають ланцюг і гальванометр показує величину виникаючого струму. Чутливість цих фотоелементів не висока.
Для одержання добре відтворюваних і надійних результатів, при виборі ефективної довжини хвилі, необхідно враховувати не тільки спектральні характеристики розчину і світлофільтрів, але і характеристики спектральної чутливості фотоелемента (рис. 13,14).

Рис.13 Спектральні характеристики Рис. 14 Графічне зображення правила
селенового (1) і киснево-цезієвого (2) вибору світлофільтра і фотоелемента фотоелемента.
 |
Прилади, які використовуються для фотометрії
Фотоколориметри бувають - однопроменеві та двопроменеві (рис. 15).
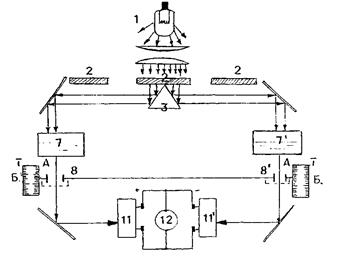
Рис. 15 Схема двопроменевого фотоколориметра ФЕК-56
Вони призначені для виміру пропускання або оптичної густини розчинів у діапазоні 340-630 нм і визначення концентрації речовин у розчині фотометричними методами. Фотоколориметри ФЕК-56М, ФЕК-56 мають однакову оптичну схему, представлену на рис. 6. Світловий потік від джерела світла 1, пройшовши через світлофільтр 2, попадає на призму 3, що поділяє потік на два, лівий і правий. Паралельні потоки проходять через кювети 7,7', діафрагми 8,8', попадають на фотоелементи 11,11', включені за диференційною схемою. Струм, що виникає, через підсилювач поступає на мікроамперметр 12. У правий світловий потік можна послідовно вводити кювету з розчинником (розчином порівняння) чи кювету з досліджуваним розчином. Розсувна діафрагма 8, розташована в правому потоці світла, при обертанні зв'язаного з нею барабана змінює значення світлового потоку, що падає на правий фотоелемент. Правий барабан є вимірювальним. Лівий - компенсаційним.
Перш ніж приступити до виконання фотометричних визначень, необхідно вибрати світлофільтр.
Фотометри, як правило, обладнані набором світлофільтрів від 4 до 10 штук з пропусканням у різних областях спектра. Для роботи дуже важливо вибрати світлофільтр, що підходить для даного аналізу, тому що чутливість виміру прямо залежить від довжин хвиль, які потрапляють у кювету, тобто від властивостей світлофільтра.
Колір розчину є додатковим до кольору поглиненого випромінювання. Так, розчин здається червоним, тому що він пропускає без зміни червону область спектра, поглинаючи при цьому синьо-зелену (табл. 4). Інтенсивність цієї області довжин хвиль змінюється найбільш різко зі зміною концентрації (Іt - мінімально). При наявності кількох світлофільтрів з близькими відтінками, вибирають той, при якому поглинання світла розчином являється максимальним 
Розрахунок концентрації речовини в розчині залежить від чутливості фотометричної реакції, обраного методу вимірювання інтенсивності забарвлення і від типу приладу, який застосовують для вимірювання. Для розрахунку концентрації речовини застосовують кілька методів.
1. Графічний метод заснований на побудові каліброваного графіка в координатах А - С (концентрація). Для цього вимірюють оптичну густину еталонних розчинів при обраному світлофільтрі, і оптичну густину досліджуваного розчину Ах, потім з допомогою калібровочного графіка визначають концентрацію речовини Сх (рис. 16, кр.1). Підпорядкування закону Бера не є строго необхідною умовою для цього методу. Якщо для від С, що представляє криву, то вона може служити калібровочним графіком, але для її побудови необхідно більше еталонних розчинів.
Таблиця 4
Кольори розчинів і відповідних їм світлофільтрів
| Колір розчину | Область максимального поглинання променів розчином, нм | Колір світлофільтра |
| Жовто-зелений | 400-450 | фіолетовий |
| Жовтий | 450-480 | синій |
| Жовтогарячий | 480-490 | зелено-синій |
| червоний | 490-500 | синьо-зелений |
| Пурпурний | 500-560 | зеленй |
| Фіолетовий | 560-575 | жовто-зелений |
| Синій | 575-590 | жовтий |
| Зелено-синій | 590-625 | жовтогарячий |
| Синьо-зелений | 625-700 | червоний |
2. Розрахунковий аналітичний метод. Готують один стандартний розчин і вимірюють його оптичну густину Аст. По формулі розраховують εреал, і визначивши Адослід, знаходять невідому концентрацію: досліджуваних у визначених умовах речовин, установлені відповідна залежність А 
3. По молярному коефіцієнту поглинання 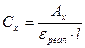 Для визначення необхідно знати точні значення молярного коефіцієнта поглинання в реальних умовах, тому метод використовується рідко.
Для визначення необхідно знати точні значення молярного коефіцієнта поглинання в реальних умовах, тому метод використовується рідко.
4. Метод добавок. У дві мірні колби відбирають визначений об'ємрозчину досліджуваної речовини. В одну з цих колб додають стандартний розчин. Після переведення компонента в забарвленусполуку, об'єми розчинів в колбах доводять до мітки фоном івимірюють оптичну густину цих розчинів.
Якщо 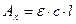
 то можна записати
то можна записати 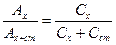 звідки
звідки 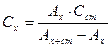
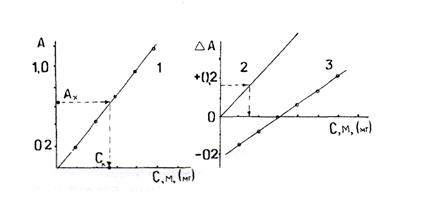
Рис.16 Калібрувальні графіки звичайної (1) та диференційної (2,3) фотометрії
Не нашли, что искали? Воспользуйтесь поиском: