
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Квантові числа електронів у атомі
Силове поле, що зумовлює рух електрона в атомі водню (електростатичне поле кулонівської взаємодії), є сферично симетричним (залежить тільки від радіусу орбіти r і не залежить від напрямку). Потенціальна енергія електрона (5.41) також є сферично симетричною. Тому і хвильові функції електрона в атомі водню, які є розв’язками диференціального рівняння Шредінгера (5.42), мають сферичну симетрію. У зв’язку з цим, при розв’язуванні даного рівняння використовують не декартову, а сферичну систему координат і отримують хвильові функції, які залежать від координат r, q і j:
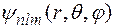 . (5.45)
. (5.45)
Вигляд функціональної залежності визначається трьома індексами – цілочисельними параметрами n, l і m, кожному набору яких відповідає своя хвильова функція, яка визначає відповідний стан електрона в атомі. З точки зору математики, кожна з цих функцій входить до множини власних функцій диференціального рівняння (5.42).
Цілочисельні параметри n, l і m, які називаються квантовими числами електрона, визначають енергію і момент імпульсу електрона, які він має внаслідок свого руху по орбіті і взаємодії з атомним ядром. Крім того, задавання цих трьох чисел однозначно визначає вигляд хвильової функції, тобто стан електрона в атомі водню.
Головне квантове число n визначає енергетичні рівні електрона в атомі і може набувати будь-яких цілочисельних значень, починаючи з одиниці: n = 1, 2, 3,...
Енергія електрона в атомі водню визначається формулою (5.43) і є дискретною, тобто квантується.
Як показує аналіз рівняння Шредінгера (5.42), момент імпульсу електрона також квантується, тобто може набувати лише певних дискретних значень, які визначаються двома іншими квантовими числами l і m.
На відміну від енергії, яка є скаляром і для визначення якої досить одного квантового числа п, момент імпульсу є вектором, а тому для його визначення необхідно задати два квантових числа, одне з яких визначає його модуль, а інше – напрямок у просторі.
Орбітальне квантове число l визначає модуль орбітального моменту імпульсу електрона, який він має внаслідок свого руху по орбіті навколо ядра. При заданому п орбітальне квантове число може набувати таких цілочисельних значень:
l = 0, 1, 2,..., (n – 1). (5.46)
Модуль орбітального моменту імпульсу електрона для певного значення орбітального квантового числа l можна визначити за допомогою співвідношення:
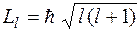 . (5.47)
. (5.47)
Просторова орієнтація моменту імпульсу визначається по відношенню до існуючого у просторі магнітного поля.
Магнітне квантове число т визначає проекцію орбітального моменту імпульсу електрона на напрямок зовнішнього магнітного поля (напрямок z, рис. 5.7). При заданому l воно може набувати таких цілочисельних значень:
m = – l, – l + 1, …, – 1, 0, 1,..., l – 1, l, (5.48)
тобто всі цілі числа від – l до l, всього 2 l + 1 значень.
 З рішень рівняння Шредінгера можна знайти, що проекцію орбітального моменту імпульсу на напрямок зовнішнього магнітного поля (напрямок z) для певного значення магнітного квантового числа т можна визначити за допомогою співвідношення:
З рішень рівняння Шредінгера можна знайти, що проекцію орбітального моменту імпульсу на напрямок зовнішнього магнітного поля (напрямок z) для певного значення магнітного квантового числа т можна визначити за допомогою співвідношення:
 . (5.49)
. (5.49)
Підсумовуючи все вищесказане, зазначимо, що енергія електрона залежить лише від його головного квантового числа п. З наведених вище співвідношень можна зробити висновок, що кожному значенню енергії (кожному п) відповідає кілька власних функцій yпlm, які відрізняються значеннями квантових чисел l і m. Це значить, що атом водню може мати одне й те саме значення енергії у кількох різних квантових станах.
Стани з однаковою енергією називаються виродженими, а число різних станів з однаковим значенням енергії називається кратністю виродження відповідного енергетичного рівня.
Кратність виродження G кожного енергетичного рівня з певним значенням п можна легко обчислити, враховуючи можливі значення квантових чисел l і m (див. (5.46) і (5.48)). Оскільки кожному значенню п відповідає п різних значень квантового числа l (від 0 до п – 1), а кожному з цих значень l відповідає 2 l + 1 різних значень квантового числа m, то загальна кратність виродження може бути обчислена як сума ряду:
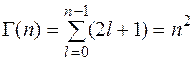 . (5.50)
. (5.50)
Таким чином, для електрона в основному стані атома водню (п = 1) кратність виродження G дорівнює 1. Справді, при п = 1 можливий лише один набір квантових чисел: l = 0, m = 0.
Для електрона на першому збудженому рівні п = 2 кратність виродження дорівнює 22 = 4. При цьому можливі такі набори квантових чисел l і m:
l = 0, m = 0;
l = 1, m = – 1;
l = 1, m = 0;
l = 1, m = 1.
Аналогічно можна визначити всі можливі комбінації квантових чисел (тобто індексів хвильових функцій) для будь-якого енергетичного рівня.
Для кожного набору квантових чисел існує відповідний розв'язок рівняння Шредінгера – хвильова функція даного квантового стану електрона. Як відомо із сказаного вище (див. “співвідношення невизначеностей”), точні координати та імпульси електрона визначити неможливо внаслідок наявності у нього хвильових властивостей. Тому про електронну орбіту в класичному розумінні цього слова говорити не має сенсу. Електрон не є частинкою, яка рухається вздовж певної траєкторії. Він існує одночасно у всьому об’ємі атома, утворюючи щось на зразок “електронної хмарини”, густина якої пропорційна густині імовірності знаходження електрона в тій чи іншій точці простору.
Густина імовірності дорівнює квадрату хвильової функції (див. (5.21)), а отже, залежить, як і сама функція, від набору квантових чисел.
Квантові числа n і l визначають розмір і форму електронної хмарини, а квантове число m – її орієнтацію в просторі.
В атомній фізиці застосовуються умовні позначення для квантових станів з різними значеннями орбітального квантового числа, при яких кожному значенню l відповідає певна літера латинського алфавіту:
l = 0 – s;
l = 1 – p;
l = 2 – d;
l = 3 – f.
При записі певного стану електрона значення головного квантового числа n записується перед умовним позначенням орбітального числа. Наприклад, запис 2 s означає, що в даному стані n = 2, l = 0.
Отже, рух електрона в атомі навколо ядра визначається трьома квантовими числами n, l і m. Але експериментальні дослідження виявили, що електрону властивий ще один вид руху – внутрішній. Класичним аналогом цього руху є обертання тіла навколо осі, що проходить через його центр мас (так само, як планета Земля, обертаючись по орбіті навколо Сонця, одночасно обертається і навколо власної осі). Внаслідок цього руху електрон має ще один момент імпульсу, не пов’язаний із його рухом навколо ядра атома. Цей власний момент імпульсу електрона, який електрон має завжди, в будь-яких умовах, називається спіном і позначається 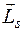 .
.
Як і орбітальний момент імпульсу, спін електрона квантується за законом, подібним до (5.47):
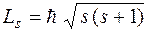 , (5.51)
, (5.51)
де s – спінове квантове число.
Експериментально було визначено, що для електрона s = 1/2.
Проекція спіну на напрямок зовнішнього магнітного поля визначається співвідношенням, подібним до (5.49):
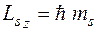 , (5.52)
, (5.52)
де ms – магнітне спінове квантове число. Це квантове число для електрона може мати тільки 2 значення:
ms = ± 1/2. (5.53)
Спін властивий не лише електрону, але й іншим елементарним частинкам: протону, нейтрону, фотону та іншим, а також складним квантовим системам, що складаються з елементарних частинок (ядра, атоми, молекули тощо).
Наявність у електрона додаткового (внутрішнього) ступеня свободи – спіна, приводить до того, що для повного визначення стану електрона в атомі необхідно враховувати і орієнтацію спіна відносно зовнішнього магнітного поля, тобто магнітне спінове квантове число ms. Оскільки воно може мати два значення (5.53), то число можливих квантових станів, що відповідає певному енергетичному рівню (кратність виродження) необхідно помножити на 2 (див. (5.50)):
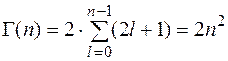 . (5.54)
. (5.54)
Наприклад, для електрона на першому енергетичному рівні (п = 1) кратність виродження G дорівнює 2. Це два квантові стани, які відрізняються орієнтацією спіна – вздовж магнітного поля і проти поля.
Наведені вище співвідношення та висновки зроблені по відношенню до найпростішого з усіх атомів – атома водню, який має лише один електрон. Але їх можна розповсюдити і на всі інші атоми, що мають велику кількість електронів.
Отже, стан електрона в будь-якому атомі характеризується 4-ма квантовими числами:
головне квантове число n,
орбітальне квантове число l,
магнітне квантове число т,
магнітне спінове квантове число ms.
Оскільки число можливих квантових станів електрона в атомі, внаслідок необмеженості числа n, є нескінченно великим, виникає питання про те, в яких станах знаходяться всі електрони багатоелектронного атома.
(Не обов’язково)
Не нашли, что искали? Воспользуйтесь поиском: