
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Подготовка биопреобразования Амперометрические сенсоры
Оксидазные электроды
D Ферменты оксидазы, образующие пероксид водорода, можно использовать для амперометрического определения пероксида.
Первое сообщение о биосенсоре приписывают Кларку и Лайонсу [7.8-29]; они описали «ферментный электрод», в котором использовали глюкозооксидазу в качестве селективной биораспознающей молекулы для определения глюкозы. Фермент удерживался в мембранном сандвиче вблизи платинового электрода. Pt-электрод, поляризованный при +0,6В относительно НКЭ, давал отклик на пероксид водорода, образующийся в ферментативной реакции (схема7.8-7). Это сообщение привело к разработке анализатора глюкозы для определения глюкозы в крови. Трудно отыскать более благоприятное преобразование биологической системы, чем то, которое осуществлялось в таком амперометрическом ферментном биосенсоре, т. е. перенос электрона, связанный с редокс-ферментом. Тем не менее измеряемым параметром был не прямой перенос электрона между ферментом и электродом, а реакция продукта превращения — пероксида водорода. Преобразованный электродный сигнал, таким образом, не является прямым.
Идентифицировать каталитический механизм можно довольно просто с помощью анализа отношения г/г;1/2, которое возрастает с ростом v. Рабочая кривая, опубликованная Николсоном и Шейном в 1964 г. [7.8-30], позволяет оценить /с4 из отношения кинетически контролируемого тока (/k) к диффузионно контролируемому току (/d). Когда фермент насыщен субстратом ([S] 3> km), модель можно аппроксимировать к реакции первого порядка, посредством чего можно получить константу скорости реакции псевдопервого порядка k. Если же рассчитать k для различных концентраций [Е], можно получить константу скорости второго порядка k".
Пример
Ферроценмонокарбоновую кислоту (РсСООН) испытывали в качестве медиатора для глюкозооксидазы (GOD). В табл. 7.8-2 представлены данные, полученные из пика тока окисления на циклической вольтамперограмме FcCOOH в буферном растворе: 1) в отсутствие GOD (/ = /d из уравнения 7.8-7) и 2) в присутствии GOD и насыщающего количества глюкозы (0,05 М) (/ определяется каталитической реакцией по мере уменьшения v).
Для фиксированной концентрации фермента ток 1^ связан с /а с помощью множителя:
 (7.8-11)
(7.8-11)
Для измеренного отношения /k//d величину ^/(k/a) можно получить из рабочей кривой [7.8-30]. Когда k > а (низкая v), то связь линейна и каталитический процесс доминирует. В этой области график зависимости (k/a) от l/v представляет собой прямую линию с наклоном kRT/nF. Рис. 7.8-11 изображает графики k/a для различных концентраций GOD, дающие k.
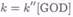 (7.8-12)
(7.8-12)
где k — константа скорости псевдопервого порядка, а k" — константа скорости второго порядка. На рис. 7.8-12 построен график зависимости k, взятых из рис. 7.8-11, от [GOD], чтобы получить k". Получена константа скорости второго порядка, равная 1,9-105 л-моль. 1-с~1. Это сравнимо с оценкой 15-105 л-моль"1^"1 для окисления GOD кислородом, и, таким образом, показано, что производное ферроцена является хорошим медиатором.
Таблица 7.8-2. Данные из пика тока окисления ферроценмонокарбоновой кислоты в присутствии глюкозы с GOD (Ik) и без GOD (Id)
| Скорость сканирования (1) | (2) | |||||
| v, мВ/с | 1ц, мА | Ik, мА | ||||
| 5,7 мкМ | 12,6 мкМ | 16,4 мкМ | 23,7 мкМ | 32,4 мкМ | ||
| [GOD] | [GOD] | [GOD] | [GOD] | [GOD] | ||
| 17,0 | 19,4 | 23,4 | 24,6 | 27,8 | 33,4 | |
| 14,6 | 17,4 | 21,8 | 23,8 | 27,2 | 32,6 | |
| 11,8 | 15,4 | 20,4 | 23,9 | 26,6 | 32,0 | |
| 8,2 | 13,4 | 19,4 | 22,2 | 25,8 | 31,0 | |
| 5,0 | 12,8 | 18,8 | 21,6 | 25,0 | 29,8 | |
| 3,6 | 12,7 | 18,4 | 21,2 | 24,6 | 28,8 | |
| 2,5 | 2,4 | 12,6 | 18,0 | 20,8 | 23,8 | 28,0 |
Скорость
сканирования (1) (2)
v, мВ/с Id, мА /fc, мА
5,7 мкМ 12,6 мкМ 16,4 мкМ 23,7 мкМ 32,4 мкМ [GOD] [GOD] [GOD] [GOD] [GOD]
100 17,0 19,4 23,4 24,6 27,8 33,4
75 14,6 17,4 21,8 23,8 27,2 32,6
50 11,8 15,4 20,4 23,9 26,6 32,0
25 8,2 13,4 19,4 22,2 25,8 31,0
10 5,0 12,8 18,8 21,6 25,0 29,8
5 3,6 12,7 18,4 21,2 24,6 28,8
2,5 2,4 12,6 18,0 20,8 23,8 28,0

|

|
| Схема 7.8-10.Пути реакций согласно связанному с редокс-ферментом ампе-рометрическому измерению с помощью редокс-медиатора. б — определение глюкозы; (а)+(б) — определение креатина, креатинкиназы или гексокиназы. |

| Рис. 7.8-12.График зависимости k от [GOD] для определения fc". |
Рис. 7.8-11. Отношение k/a в зависимости от [GOD], дающее ряд значений k.
П Медиатор можно использовать для окисления оксидазы вместо кислорода, но он должен конкурировать с кислородом.
Оксидазный электрод, сконструированный для контроля тока окисления Medred и использующий на стадии окисления либо кислород, либо медиатор, испытывает значительное влияние кислорода на точность измерения сигнала. В этой ситуации &з и k± (схемы 7.8-5 и 7.8-9, схема 7.8-6,а) конкурируют. Такой медиаторный ферментный электрод может давать заниженный сигнал, если кинетика медиатора (k^) не превосходит окисление молекулярным кислородом (&з).
Оптимизация одного ферментативного определения может создать основу для аналогичных схем и позволяет определять другие вещества помимо первоначально интересующего определяемого вещества. Например, схема 7.8-10, а/б показывает, как можно применить систему с глюкозооксидазой в «конкурентной» реакции глюкозы с другими ферментами, использующими глюкозу в качестве субстрата, и, таким образом, определять, например, креатин, гексокиназу или креатинкиназу [7.8-31]. Если же медиатор применяют в качестве метки для антигена, комплекс антиген-медиатор можно использовать в иммуноферментном анализе (схема 7.8-11). Эта схема [7.8-32] определяется меченным ферроценом (Fc) комплексом антиген-антитело, который дезак-
Схема 7.8-11. Пути реакций согласно связанному с редокс-ферментом ампе-рометрическому измерению с помощью редокс-медиатора, для конкурентного иммунного анализа с использованием антигена, меченного ферроценом.
тивирован по отношению к переносу электрона к ферменту, а несвязанный в комплекс меченый антиген остается активным.
Такие медиаторные определения могут оказаться элегантным решением для биосенсоров. Тем не менее, оптимизация только реагента не является исчерпывающим решением. Как указывалось ранее, в биосенсоре реагент должен быть иммобилизован, чтобы взаимодействовать и с определяемым веществом, и с преобразователем как самодостаточная система.
Другие редокс-ферменты (схема 7.8-6) предполагают те же общие принципы, если их включают в биосенсор, но каждый класс имеет тонкие отличия.
Ферментные электроды на основе NAD
П Восстановление NAD+ на электроде приводит к образованию димеров и не служит оптимальным (удобным) аналитическим сигналом.
В окислительно-восстановительных процессах большого класса ферментов вместо молекулярного кислорода используется никотинамиднуклеотид NAD
или его фосфат NAD(P). Это, как правило, дегидрогеназы, участвующие в реакциях переноса водорода и описанные в схеме 7.8-6,5. Косубстратом NAD является растворимый компонент, который ассоциирован с ферментом во время реакции, но способен отсоединиться от фермента и перемещаться в объем раствора.
Существуют также многие NAD-дегидрогеназы, для которых ферментативная реакция протекает в обратном направлении, приводя, таким образом, к образованию NAD+. В случае биосенсора сигнал получали бы за счет восстановления NAD+. Восстановление NAD+ на электроде имеет тенденцию к образованию (путем радикальной полимеризации) димеров, а не восстановленного кофактора NADH. Эти димеры адсорбируются на поверхности электрода, что делает NAD+ непригодным для использования в качестве компонента биосенсора.
D Окисление NADH на электроде обычно требует большого перенапряжения.
Окисление NADH в NAD+ можно проводить на графитовом электроде, но оно обычно идет с высоким перенапряжением или сопровождается порчей электрода [7.8-33]; следовательно, более приемлемо выполнять косвенное окисление через медиатор или сочетать окисление с другой сопряженной ферментативной реакцией, как показано на схеме 7.8-10. Эти окислительно-восстановительные агенты должны обладать теми же свойствами, что описанные в предыдущем разделе, и, хотя медиаторная кинетика не должна ограничивать реакцию, здесь нет конкуренции с молекулярным кислородом.
Ферменты пирролохинолинхинона
Для хинопротеинов молекулы хинонов играют роль кофакторов и простетиче-ских групп. В большинстве бактериальных хинопротеинов пирролохинолинхи-нон (ПХХ) связан прочно, но не ковалентно. Большинство хинопротеинов является дегидрогеназами и часто не требует растворимых кофакторов: природным электронным акцептором служит медьсодержащий белок или связанный в мембране убихинон. Эти ферменты можно использовать таким же образом, как и оксидазы. В рутинном анализе используют искусственные электронные акцепторы (схема 7.8-6,е) и подобно системам с NAD, обсуждаемым выше, эти искусственные медиаторы не подвержены мешающему влиянию кислорода, которое имеет место для оксидаз, поскольку U2 не является косубстратом для этих ферментов [7.8-34, 7.8-35].
Клетки и клеточные компоненты
D Живые клетки можно использовать как распознающий компонент.
Обсуждение мы до сих пор проводили, делая упор на ферменты в качестве биораспознающего компонента. Но этим компонентом не обязательно должен быть изолированный фермент, вместо этого можно использовать живую клетку [7.8-36] или компонент клетки. Описаны микробные сенсоры с некоторой специфичностью к различным определяемым веществам: от С02 до витамина В. Описано также приготовление тканей, на основе любых источников, которые
только можно вообразить: банановая мякоть или яблочный порошок, например, содержат высокие концентрации полифенолоксидазы, которую можно использовать для определения допамина и катехинов [7.8-37, 7.8-38]. В большинстве случаев устройства на основе этих клеток связаны с изменением давления 02, которое контролируют с помощью амперометрического электрода, установленного за клеточным слоем. Это позволяет связать клеточное «дыхание» с присутствием данного определяемого вещества. Подобно описанным выше измерениям, в данном случае также осуществляется косвенное определение.
В отличие от обсуждаемых выше систем со свободным ферментом, транспорт как определяемого вещества, так и «курьерской частицы» между электродом и биораспознающим элементом внутри клетки может быть ограничен стенками клетки и мембранами, и химия окислительно-восстановительной молекулы (медиатора) должна быть выбрана так, чтобы обеспечить нужные свойства мембранного транспорта, а также нужную электрохимию. Такие факторы, как липофильность и поверхностные взаимодействия, играют более важную роль, чем при приготовлении ферментов.
П Некоторые гербициды можно определять, по их ингибированию фотосинтеза.
Пример клеточного медиатора можно найти в области контроля остаточных содержаний гербицидов через механизм электронного транспорта при фотосинтезе (ЭТФ) с использованием цианобактерий или тилакоидных мембран [7.8-39]. Многие гербициды действуют как ингибиторы ЭТФ, часто между двумя фотосистемами (PSI и PSII), как показано на рис. 7.8-13, а результатом является уменьшение фототока.
В принципе, возможно получить один или несколько редокс-циклов между редокс-белком и электродом. Например, в описанной выше системе ЭТФ имеется NADPH-дегидрогеназа, которая расположена в плазменной мембране, связанной с выходом ЭТФ (верхняя часть рис. 7.8-13). Измерение возможно с помощью передачи через медиатор (например, феррицианид) и можно избежать таких проблем, как необходимость пересечения медиатором мембран; однако NADP проходит долгий путь «по течению» от исходной точки ингибирования, и поэтому такой косвенный путь с большей вероятностью будет подвержен мешающему влиянию других частиц «не определяемого» происхождения.
Хорошими акцепторами электронов для PSII являются п-фенилендиамины. В целом С-замещенные n-фенилендиамины способны входить в клетку (рис. 7.8-14), восстанавливаться в системе PSII и выходить из клетки. N-Замещенные, однако, остаются в просвете после восстановления в PSII и, следовательно, не завершают медиации доставкой сообщения на электрод [7.8-40].
Не нашли, что искали? Воспользуйтесь поиском: