
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Потенциометрические сенсоры
D Потенциометрические измерения связаны с уравнением Нернста.
Не все вещества можно определить с помощью окислительно-восстановительной системы; следует испробовать другие параметры, а не только перенос электрона. Действительно, даже если для интересующего нас определя-
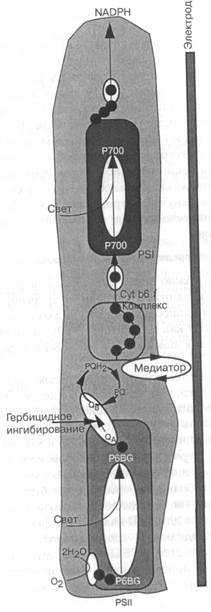
|
Рис. 7.8-13. Схематическое изображение цепи электронного транспорта фотосинтеза (ЭТФ). На входе —Н2О и свет, на выходе-NADP и О2. Белки ЭТ< представлены с помощью сокращенных названий или в виде темных кружков.
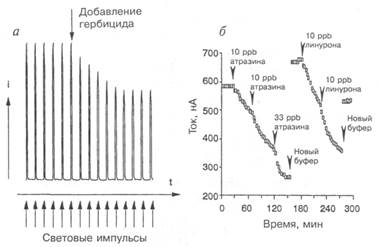
Рис. 7.8-14. Диаминодурол (С-замещенный n-фенилендиамин) в качестве медиатора фототока в клетках Synechococcus. a — ток электрода как отклик на импульс света. Транспорт заряда и PSII активируется и прерывается медиатором на Q-белке (рис. 7.8-13); б — детектирование двух активных в ЭТФ гербицидов. График пикового фототока построен в зависимости от времени (ppb — миллиардные доли).
емого вещества имеется редокс-фермент, он может не всегда подходить для применения амперометрического метода. Альтернативой являются потенцио-метрические измерения.
Интерпретация сигнала
Измеряемый потенциал (Е) определяется уравнением Нернста (разд. 7.3), и для изменения активности иона i это уравнение имеет вид:
 (7.8-13)
(7.8-13)
так что измеряемый параметр логарифмически связан с концентрацией определяемого вещества. Как мы уже видели (разд. 7.3), хитрость с потенциомет-рическим измерением заключается в том, чтобы заставить его отвечать селективно только на один ион; соответственно в биосенсоре изменение ионного транспорта должно происходить в результате биораспознавания. [Н+] — главная переменная, хотя величина рН может изменяться непосредственно или через равновесие с СОз или NHs- В последнем случае можно использовать мембрану, содержащую ионофор на аммоний, или рН-чувствительную поверхность.
В случае изменения рН, связанного с ферментом, конечный отклик рН-сенсора зависит от баланса всех равновесий, включающих Н+: реакций прото-нирования и депротонирования продуктов ферментативной реакции, буферной емкости и т. п. Если рассматривать только прямой «выход» ферментативной реакции, без равновесий, связанных с буферной емкостью и т. д., и предпола-
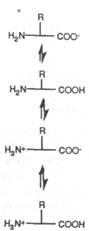
|
гать, что [Н+] непосредственно связан с расходом субстрата (S), то измеряемый потенциал будет связан с [S]. Как видно из предыдущего обсуждения, касающегося амперометрической стационарной модели, ход взаимодействия предсказывают, оценивая как диффузия в слое иммобилизованного фермента влияет на ферментативную кинетику. Здесь нет медиатора и конкуренции с молекулярным кислородом, вместо этого имеется прямое определение продукта ферментативной реакции. Используя подход, подобный описанному выше, и начиная с уравнения
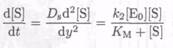 (7.8-14)
(7.8-14)
где у — расстояние поперек мембраны, получаем тот же модуль Тиле, дающий информацию об источнике изменения величины сигнала
 (7.8-15)
(7.8-15)
Применение подходящих граничных условий приводит к значениям концентрации субстрата и/или продукта поперек ферментного слоя. Решение показывает, что когда km 3> [8ь], поверхностная концентрация на лежащей ниже потенциометрической мембране связана с [Зь]. Однако, когда km «С [Зь], отклик будет зависеть от относительных скоростей ферментативной реакции и диффузионного массопереноса и не будет зависеть от [Зь].
Как упомянуто выше, баланс между ферментативным и буферным равновесиями вносит вклад в измеряемый сигнал. Теоретическая кинетическая модель, учитывающая все эти связанные явления, предсказывает стационарный отклик ферментного рН-сенсора [7.8-41]; существование «нернстовского» наклона не предсказано и не имеет такого значения, как для ион-селективных электродов, выполняющих прямое измерение ионного транспорта.
Была сделана попытка объяснить эффект, связанный с белком на границе раздела [7.8-42], и показать, как можно использовать оксидную поверхность полевого транзистора (ПТ) для наблюдения за динамическим откликом белков. На амфотерной поверхности неорганического оксида гидроксильные группы находятся в равновесии (схема 7.8-12), и, таким образом, на поверхностный потенциал Ф будет влиять значение рН в объеме ([Н^]) в зависимости от буферной емкости поверхности. Поверхности, имеющие большие количества групп OHJ и 0~, поддерживают значение [Н+] (Н+ в «растворе» вблизи от поверхности) постоянным в широком интервале рН, при этом Ф должен иметь нернстовский отклик на [Н^].
Когда белок также находится на поверхности, равновесие принимает более сложный вид. Белок состоит из большого числа пептидов, содержащих ионизирующиеся группы, каждая из которых имеет свое собственное равновесное значение рН (схема 7.8-13). Отношение активностей внутренних (iin) и внешних (iex) подвижных ионов в этой «системе» дает вклад в потенциал Доннана:
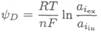

| Схема 7.8-13.Пептидные равновесия. |
Схема 7.8-12. Амфотерное равновесие на поверхности неорганического
оксида.
При рН, смещенном от изоэлектрической точки pi, этот потенциал соответствует разности между «внутренним рН» белка и раствором. Любые изменения ajex будут вызывать изменение 4т> и заставлять белок высвобождать или принимать протон, чтобы восстановить равновесие. Во время этого восстановления непосредственное окружение белка будет испытывать временное изменение рН из-за притока/оттока протонов. Если белок иммобилизован вблизи от ион-селективного полевого транзистора (ИСПТ), это влияние концентрации ионов можно измерить, потому что ИСПТ очень быстро реагирует на изменения поверхностного заряда.
Ферментативный анализ
Потенциометрические измерительные устройства наиболее часто разрабатывают на основе рН-чувствительных электродов, и в рН-ПТ используют те же аналитические реагенты, что и в ИСЭ. Можно применять любую ферментативную реакцию, которая приводит к изменению Н+ (например, схемы 7.8-2 и 7.8-14).
Использование биораспознающих молекул для анализа обеспечивает специфичность отклика биосенсоров. Однако специфичность зависит от природы биораспознающей системы. Менее специфичная распознающая система может быть невыгодной, но в некоторых случаях, когда при этом проявляется специфичность к другим субстратам, она может оказаться полезной. Например, каталитическое расщепление связи углерод-фтор с помощью пероксидазы хрена в присутствии сенсора на фторид-ион [7.8-43] дает полезный способ детектирования фторорганических соединений.

D Потенциометрический сигнал часто можно получить косвенным путем, вызывая изменения поверхностного заряда или селективного транспорта частиц.
В разд. 7.3 показаны другие системы потенциометрического измерения, которые могут быть пригодными для сочетания с ферментативными реакциями. Рассмотрите различные классы ферментов и определите, какие из них пригодны для потенциометрического анализа.
Иммунный анализ
Другим приложением потенциометрических сенсоров и устройств ПТ является иммунный анализ, включающий образование комплекса антитело-антиген [7.8-44]. Теоретические основы этих измерений не всегда ясны. Например, Аизава [7.8-45] приготовил и установил в потенциометрической ячейке специфичную к антителам Вассермана мембрану на основе липидного антигена из кардиоли-пина, фосфатидилхолина и холестерина в триацетилцеллюлозе. Предполагают, что отклик возникает за счет изменения ионообменных свойств мембраны при связывании антитела. Шасфурт и др. [7.8-46] сообщали о способе применения серии ступенчатых изменений концентрации электролита и контроля мембранного потенциала с использованием Нечувствительного ПТ с быстрым откликом (см. разд. 7.8-3) как методе иммунного анализа. Этот метод подходит для измерения любого процесса на поверхности, который включает изменение поверхностного заряда.
Оптические сенсоры
D Оптические биосенсоры работают во внешнем или внутреннем режиме.
В предыдущих разделах об электрохимических биосенсорах для создания биосенсора манипулировали несколькими различными методами биоанализа. На примерах было показано, как можно связать биораспознающий механизм с физическим методом измерения либо напрямую, либо через медиатор. Используя тот же подход, можно разрабатывать биосенсоры на основе различных методов преобразования. В этом разделе обсуждаются особенности оптического преобразования.
Оптические биосенсоры бывают двух типов, которые отличаются по оптической конфигурации. Во внутреннем режиме падающая волна не проходит через объем пробы, а проходит в световод и взаимодействует с пробой на поверхности в затухающем поле. Во внешнем режиме падающий свет взаимодействует непосредственно с пробой, или проходя через нее или отражаясь от фазы пробы. В этом случае свет от источника не обязательно должен проходить через световод, хотя иногда бывает целесообразно передавать свет от источника к удаленной точке измерения через оптическое волокно.
Некоторые анализы биологических сред можно проводить без вмешательства биораспознающей поверхности, которая характеризует биосенсор, поскольку определяемое вещество обладает характерными ему оптическими свойствами. Например, уровни содержания кислорода in situ определяют по сдвигу поглощения между гемоглобином и оксигемоглобином. В отличие от этого, в оптическом биосенсоре определение зависит от биораспознавания в
иммобилизованном слое преобразователя; и подобно тому, как в электрохимических методах можно использовать косвенные измерения и медиаторы, для оптических систем можно применять метки. Однако в оптическом анализе такие метки могут быть «пассивны» или сами реагировать с определяемым веществом или продуктом биореакции. Многие из этих возможностей анализа обсуждались в предыдущих главах.
D Оптические метки могут быть «пассивными» индикаторами или принимать участие в реакции с определяемым веществом.
Как правило, в устройствах с визуальным детектированием используются хромогенные, окрашенные реагенты-метки, тогда как красители для иммунного анализа обычно являются производными флуоресцеина. Производные флуоресцеина далеко не идеальны для сенсорных приложений, поскольку они рН-чувствительны и имеют короткую длину волны возбуждения (Авозб), что накладывает ограничения на используемые оптические материалы. Более предпочтительны флуорофоры с большей АВОЗб и достаточным стоксовым сдвигом (например, Техас красный). Измерять можно или непосредственно интенсивность флуоресценции, или, если протекает реакция тушения (например, тушение флуорофоров кислородом), время жизни флуоресценции. В этом случае уравнение Штерна—Фольмера принимает вид
 (7.8-17)
(7.8-17)
где.ЙТ--константа тушения, а т —время жизни флуоресценции [7.8-47, 7.8-48]. Следует помнить, что в анализе с биораспознаванием зависимость тушения может быть подвержена серьезным помехам, поэтому следует хорошо продумать конструкцию слоев, чтобы избежать этого.
В целом, желательно использовать метки с длинноволновыми максимумами поглощения и испускания. Это предпочтительно как в случае применения световодов (поскольку наиболее общедоступные волокна плохо пропускают свет с длиной волны короче 420 нм), так и во всех других устройствах (потому что простые и наиболее дешевые источники света — светодиоды и диодные лазеры—имеют обычно длину волны больше 450нм). Работа в длинноволновой области может также иметь дополнительные преимущества благодаря более низкому флуоресцентному фону и более высокой чувствительности имеющихся фотодетекторов. Следует помнить, что не всегда удается работать в этих рамках и что некоторые из наиболее чувствительных маркирующих реагентов действуют в коротковолновой области.
Интерпретация сигнала
Рассмотрим пример, в котором метка взаимодействует с определяемым веществом. Если взаимодействие между ними можно описать просто в соответствии с равновесием
 (7.8-18)
(7.8-18)
так что
 (7.8-19)
(7.8-19)
и общая концентрация метки в иммобилизованной фазе равна
 (7.8-20)
(7.8-20)
тогда
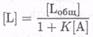 и
и 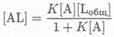 (7.8-21)
(7.8-21)
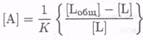 или
или 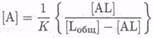 (7.8-22)
(7.8-22)
П Если аналитическую реакцию можно описать как обратимое равновесие, то в результате аналитический сигнал не будет линейным.
Эти уравнения подразумевают, что отклик на определяемое вещество может не быть линейным во всем интересующем диапазоне концентраций. При анализе растворов в объеме эту проблему часто преодолевают, подбирая количество используемой метки таким образом, чтобы ее реакция с определяемым веществом попадала в диапазон, где сигнал пропорционален концентрации L или AL, в зависимости от того, какое из них вызывает оптический сигнал (например, для измерения [AL] должно быть [Ь0бЩ]» [AL]). В противоположность этому, в иммобилизованной фазе обычно более сложно манипулировать концентрацией, чтобы попасть в этот диапазон. Вместо этого можно предложить сравнение двух длин волн, где [AL] и [L] имеют различное поглощение, дающее отношение, не зависящее от [Ь0бщ]:
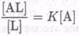 (7.8-23)
(7.8-23)
Второй способ заключается в использовании меток как «пассивных» индикаторов. Существует несколько типов сенсоров, в которых можно использовать метки таким образом. Например, в простом конкурентном связывающем анализе в растворе отклик можно моделировать с помощью следующих двух равновесий: во-первых, между антителом или связывающим белком (Вр) и определяемым веществом (А), и, во-вторых, между антителом или связывающим белком и меченым аналогом определяемого вещества (а*):
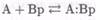
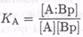 (7.8-24)
(7.8-24) 
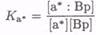 (7.8-25)
(7.8-25)
П Сенсор должен быть способен различать реагенты из правой и левой частей равновесия.
Следует ожидать, что эти равновесия будут сохраняться и при иммобилизации Вр, если константы относительного сродства К& и К&» не зависят от концентрации и ограничений, накладываемых иммобилизацией на реакцию с
Вр. Равновесие не будет зависеть от концентрации, если связывание на одном Вр не влияет на связывание на соседнем Вр. Если это справедливо и
 (7.8-26)
(7.8-26)  (7.8-27)
(7.8-27)  (7.8-28)
(7.8-28)
тогда будут измерять  или
или 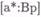 , в зависимости от того, каким образом
, в зависимости от того, каким образом
устроен сенсор, и от их концентраций, на которые влияет отношение констант относительного сродства К а и Ка*. С помощью подстановки в приведенные уравнения получаем
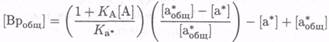 (7.8-29) так что нормированный сигнал за счет [а*]/[а*бщ] определяется выражением
(7.8-29) так что нормированный сигнал за счет [а*]/[а*бщ] определяется выражением
 (7.8-30) и
(7.8-30) и
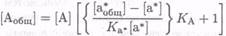 (7.8-31)
(7.8-31)
Отношение [Вробщ]:  , а также К&: К&* являются критичными для на-
, а также К&: К&* являются критичными для на-
стройки диапазона отклика и могут быть подобраны для оптимальной работы.
Из этого обсуждения можно сделать вывод, что одной из основных задач, необходимых для оптического биосенсора, независимо от того, используют «пассивную» или «активную» метку, является способность различать «свободное», или немеченое, определяемое вещество и «связанное», или меченое, определяемое вещество без проведения разделения при анализе, как это можно сделать в классическом биоанализе, использующем растворы!
Внешние определения с меткой Ферментативный внешний оптический сенсор
П В оптических измерениях возможно использование пероксида водорода или других продуктов ферментативных реакций таким же образом, как в электрохимических сенсорах.
Как мы видели в предыдущей главе, многие из традиционных биоопределений основаны на оптических измерениях, но все они используют растворы без иммобилизованных реагентов и иногда с этапом разделения. Тем не менее, они уже имеют многие из необходимых аналитических компонентов для создания биосенсора. Так как же можно осуществить этот переход? Оптические биосенсоры связаны с изучением реакций на поверхностях; первоочередной задачей, следовательно, становится перенесение реакции на поверхность. Многие наборы «домашних тестов» претерпели такой переход и сейчас выполняют оптические измерения. Рассмотрим, например, устройство для определения глюкозы, используемое диабетиками. Мы видели в предыдущем разделе, что глюкозу можно определять с помощью ферментативной реакции с глюкозооксидазой

|
(схема 7.8-7). В предыдущем разделе «Оксидазные электроды» (см. с. 535) мы обсуждали амперометрическое определение глюкозы, основанное на использовании пероксида водорода либо синтетического медиатора. Ранее в этой главе биоанализ включал также применение пероксида водорода, но в этом случае пероксид определяли с помощью другой реакции, приводящей к образованию окрашенного комплекса в присутствии пероксида. «Тест-полоска» оптического биосенсора должна включать все реагенты для этого биоанализа в иммобилизованном виде. Пробу помещают на полоску и контролируют развитие окраски с помощью устройства, содержащего источник света и детектор. В этом случае образующийся хромогенный комплекс служит меткой; это «активная» метка, поскольку она участвует в реакции с пероксидом, но, в отличие от рассматриваемых выше процессов (уравнения 7.8-18-7.8-23), ее образование представляет собой быстрый необратимый процесс, протекающий наряду с основной ферментативной реакцией. Существует линейная зависимость между сигналом и концентрацией пероксида: его концентрация зависит от кинетики ферментативного процесса, а не от кинетики развития окраски.
В другом примере используют ферментативную реакцию, которая включает изменение [Н+] (см., например, схемы 7.8-2 и 7.8-14). Здесь меткой будет то вещество, оптические свойства которого изменяются вместе с рН. В этом случае этап маркирования является равновесным (уравнение 7.8-17); это значит, что линейная зависимость между определяемым веществом и сигналом возможна только при определенных условиях. На выбор рН-индикатора влияет интересующий нас диапазон рН и рКй иммобилизованного хромофо-ра/флуорофора (который может быть иным, чем для раствора). Существует большое число таких соединений для различных диапазонов рН и с различными спектральными характеристиками, так что возможность комбинаций реакций высока. Однако, как упомянуто в предыдущем разделе, посвященном по-тенциометрическим измерениям, проблема, связанная с контролем реакции по изменению рН, состоит в том, чтобы характеризовать собственный рН пробы, ее буферную емкость и чувствительность равновесия к ионной силе, — каждая из этих характеристик оказывает значительное влияние на определение и должна быть принята во внимание при интерпретации результатов. Эти осложнения могут также сделать схему неподходящей.
Тем не менее, оптическую схему можно построить таким же образом, как электрохимические сенсоры, использующие отклик от косубстрата или продукта ферментативной реакции. Многие из схем анализа, обсуждаемых в предыдущих главах, подходят для такого преобразования. Например, ксантинокси-
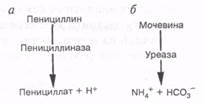
Схема 7.8-14. Ферментативные реакции, связанные с изменением рН.
ОЛ
| Схема 7.8-16.Генерация света, катализируемая люциферазой. |
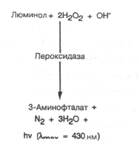
Схема 7.8-15. Хемилюминесцентная реакция люминола с пероксидом водорода.
дазу, иммобилизованную на подходящей подложке, можно использовать для определения гипоксантина и ксантина [7.8-49]. Пероксид водорода, полученный в реакции с оксидазой (см. схему 7.8-6,а), можно определять по хемилюми-несцентному механизму, основанному на реакции с люминолом (схема 7.8-15). Как можно заключить из этой схемы, для сенсора требуется совместная иммобилизация пероксидазы и подача люминола, который особенно популярен в проточно-инжекционном анализе, поскольку растворим в воде. К сожалению, в системе часто наблюдается «несовпадение» рН, потому что обычно для хе-милюминесценции требуется щелочной рН порядка 10-12, тогда как многие ферменты имеют более низкое оптимальное значение рН.
П Биолюминесценция достигает очень низких уровней определения.
Весьма привлекательно использование биолюминесцентного анализа, поскольку здесь также не требуется источник возбуждения. Биолюминесценция ассоциировлась главным образом со светлячками, у которых процесс люминесценции включает фермент люциферазу, катализирующую окисление гете-роциклов люциферина (схема 7.8-16). В другой схеме (схема 7.8-17) происходит реакция бактериальной люциферазы с восстановленным кофактором флавина. Сама реакция не обеспечивает общего метода анализа, но сочетание с кофакторами, такими, как ATP, FMN или NADH, обеспечивает ее связь с другими путями метаболизма. Получены пределы обнаружения NADH на уровне 10"1 моль и линейность, составляющая пять порядков величины.
Внешний иммунный анализ с меткой
В иммунном анализе определяемое вещество не связано с продуктом каталитической реакции, а является меткой, маркирующей наличие комплексного или свободного антигена или антитела. Основы иммунного анализа обсуждаются в разд. 7.9. Так же, как в ферментативных тест-наборах (например, для определения глюкозы), на основе иммунного анализа создано большое число тест-наборов; например, в тесте на беременность — хотя здесь результат рассчитан на наблюдение пользователя за развитием окраски и не контролируется автоматически (т. е. детектором служит человеческий глаз!). На такой тест-полоске

|
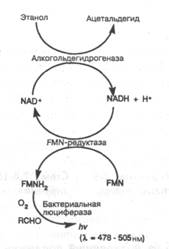
Схема 7.8-17. Использование бактериальных люцифераз в определении этанола для получения в возбужденном состоянии комплекса с восстановленным кофактором флавина (FMNH2).
меченый и немеченый комплексы обычно разделяются — разделяют фазы или используют хроматографию. Затем анализ следует модели связывания белок — определяемое вещество (уравнения с 7.8-24 по 7.8-31), в которой метка наиболее часто является ферментом, а окраска развивается на последующих этапах реакции.
В принципе, можно усовершенствовать эти общие системы, чтобы получать более количественный результат в тех случаях, когда от анализа требуется больше, чем положительный или отрицательный ответ. Конфигурация сенсора зависит от того, какой вид анализа предпочтителен: конкурентный или сандвичевый. Теоретически особенно жизненной альтернативой кажется конкурентное смещение флуоресцентной метки. Так как это равновесный процесс, то загрязнения или примеси на поверхности не должны изменять абсолютного результата, хотя вполне возможно влияние на отношение сигнал/шум [7.8-50]. Вероятным недостатком является то, что успех такого анализа со смещением очень сильно зависит от относительной кинетики связывания соединения с меткой и пробой. Для получения количественного результата они должны значительно различаться.
Общим фактором во всех этих определениях является то, что эффективность измерения зависит от этапа разделения: две формы метки должны быть отделены физически одна от другой, чтобы анализ мог их различить. Одним из способов добиться такого разделения служит проведение реакции в «мертвом объеме» сенсора, при этом измерение выполняют в определенной зоне детектирования. Такое устройство можно создать, используя ячейку с двумя отделениями: биораспознающий реагент (например, связывающий белок) иммобилизуют в одном отделении, т. е. в мертвом объеме, тогда как метка и определяемое вещество перемещаются между двумя отделениями. Определение тогда зависит от того, в правильном ли месте расположена зона детектирования.
П Эффективность измерения зависит от возможности разделить связанную и свободную метки.
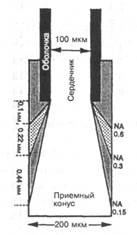
Естественная зона детектирования образована приемным конусом на конце световода (рис. 7.8-15,а). Типичный сенсор, таким образом, может использовать два световода, чтобы направлять свет к отдаленному концу, где происходит аналитическая химическая реакция, и обратно от него [7.8-51]. Оптические волокна имеют эффективное поле зрения, описываемое численной апертурой (NA) волокна, и, как можно видеть из рис. 7.8-15,а, чем больше NA, тем больше поле зрения. В описываемой выше конфигурации с двумя световодами неправильный выбор NA может привести к большому «мертвому объему» (рис. 7.8-15,5), который, очевидно, будет уменьшать измеряемый сигнал. Тем не менее, фокусировку поля для получения видимого и мертвого объемов можно использовать как преимущество в конкурентном анализе (рис. 7.8-16), где связывающий белок (Вр) иммобилизован в мертвом объеме, а проба (А) и меченый аналог (а*) конкурируют за места связывания, оставляя несвязанный а* диффундировать в облучаемый объем, где его и определяют.
|
Рис. 7.8-15. а —поле зрения в среде пробы на конце световода как функция численной апертуры (NА); б — поле детектирования в пробе при использовании двух смежных световодов для возбуждения и детектирования.

|
Рис. 7.8-16. Иммобилизация связывающего белка в «мертвом объеме» для конкурентного анализа.

|
Пример
Конканавалин А (СопА, т. е. Вр в приведенной выше модели) был связан на полой диализной трубке, установленной на конце световода в мертвом объеме (рис. 7.8-16) [7.8-52]. Оценка величины [Вр0бщ], основанная на загрузке на единицу объема трубки, дает 10 мМ. Световод имел внутренний диаметр 100 мкм и численную апертуру 0,3. Для диализной трубки с внутренним диаметром 200 мкм длина мертвого объема составила ~ 0,2мм. Раствор декстрана (а*6щ), меченного FITC, заполнял световод с общей концентрацией [а*бщ] = 1,5мМ. Сенсор был, таким образом, «заряжен» для использования. Глюкозу (А) вводили за счет диффузии в диализную трубку, что приводило к конкурентному вытеснению декстрана (а*) с СопА (ка = 3,2-102М~1; Ка. = 7, 5-Ю4 М~г). В табл. 7.8-3 приведено значение сигнала флуоресценции, связанной с а* и измеренной в относительных единицах с помощью фотодиодного детектора. Из экспериментальной градуировки можно оценить максимальный сигнал (для [а*] = [ао6щ] = 1,5мМ) и, таким образом, получить [а*]/[а*6щ].
Таблица 7.8-3. Данные по конкурентному определению глюкозы с «мертвым объемом»
| Глюкоза (А), мМ | Свободный декстран (а*), отн. ед. | Общий декстран Кбщ)' 0тН' ед' | Kl/[<sJ | Свободный декстран (рассч.), мМ |
| 2,5 | 2,4 | 0,185 | 0,28 | |
| 5,0 | 2,9 | 0,223 | 0,34 | |
| 7,5 | 3,5 | 0,269 | 0,40 | |
| 10,0 | 4,2 | 0,323 | 0,48 | |
| 12,5 | 5,1 | 0,392 | 0,59 | |
| 15,0 | 6,1 | 0,469 | 0,70 | |
| 17,5 | 6,7 | 0,515 | 0,77 | |
| 20,0 | 7,2 | 0,554 | 0,83 | |
| 22,5 | 7,5 | 0,577 | 0,86 | |
| 25,0 | 8,1 | 0,623 | 0,93 | |
| 27,5 | 8,3 | 0,638 | 0,96 | |
| 30,0 | 8,7 | 0,669 | 1,00 | |
| 32,5 | 8,9 | 0,685 | 1,03 | |
| 35,0 | 9,0 | 0,692 | 1,04 | |
| 37,5 | 9,3 | 0,715 | 1,07 | |
| 40,0 | 9,4 | 0,723 | 1,08 | |
| 42,5 | 9,5 | 0,731 | 1,10 | |
| 45,0 | 9,6 | 0,738 | 1,11 |
Свободный Свободный
Глюкоза декстран (а"), Общий декстран декстрин
(А), мМ отн. ед. (а"общ)> °тн-ед- Kl/KsJ (Р^ссч.), мМ
2,5 2,4 13 0,185 0,28
5,0 2,9 13 0,223 0,34
7,5 3,5 13 0,269 0,40
10,0 4,2 13 0,323 0,48
12,5 5,1 13 0,392 0,59
15,0 6,1 13 0,469 0,70
17,5 6,7 13 0,515 0,77
20,0 7,2 13 0,554 0,83
22,5 7,5 13 0,577 0,86
25,0 8,1 13 0,623 0,93
27,5 8,3 13 0,638 0,96
30,0 8,7 13 0,669 1,00
32,5 8,9 13 0,685 1,03
35,0 9,0 13 0,692 1,04
37,5 9,3 13 0,715 1,07
40,0 9,4 13 0,723 1,08
42,5 9,5 13 0,731 1,10
45,0____________ 9,6__________ 13_______ 0,738_____ 1,11
Построив график зависимости флуоресцентного сигнала от концентрации глюкозы (рис. 7.8-17,а), обнаружим, что при [А0бщ] > 20мМ концентрация а* становится нечувствительной к изменению [А0бщ].( Рис. 7.8-17,в предсказывает величину сигнала на основе уравнений 7.8-30 и 7.8-31 и приведенных выше значений [а*0бщ], КЛ*, ка и [Вр0бщ]. Можно видеть, что предсказанный диапазон для сенсора составляет ~ 0,5мМ глюкозы. Ряд факторов могут давать вклад в столь значительное отклонение. Модель основана на гомогенной реакции. Ранее в разделе «Теоретические основы планирования иммобилизации» (см. с. 522) было отмечено, что гетерогенные реакции, включая взаимодействия на поверхности, имеют кинетику, которая может быть функцией заполнения поверхности, и что на Ка«и К а, вероятно, оказывает влияние общая концентрация сахара ([ао6щ] + [А06Щ]). Модель также должна рас-
Рис. 7.8-17. Экспериментальный отклик анализа при конкурентном связывании в мертвом объеме в сравнении с точками данных моделирования, предполагающего простую кинетику конкурентного связывания, а — экспериментальные, б — расчетные, в — предсказанные точки.
сматривать концентрацию Вр по толщине диффузионного слоя в иммобилизованном слое (а не среднюю концентрацию, вычисленную исходя из общего объема). На деле получают лучшее «согласие» с экспериментальной кривой, если принять концентрацию иммобилизованного [Вробщ] равной 70 мМ (рис. 7.8-17,5), но действительное описание отклика должно также учитывать диффузию а* из реакционного слоя в «мертвый объем» поперек поля зрения. Сигнал не будет зависеть от диффузии только для таких концентраций, для которых время установления равновесия меньше времени диффузии.
Внутренний анализ с меткой
П Световоды обеспечивают работу оптического сенсора во внутреннем режиме.
В этом режиме реагенты иммобилизованы на поверхности световода, который находится в контакте с фазой пробы. Свет, проходящий по световоду, способен взаимодействовать с фазой пробы (показатель преломления п2), находящейся на расстоянии 0,5-1,5 длины волны от поверхности; эта область представляет электрическое поле затухающей волны. Рассматривая лучевую модель прохождения света в световоде (показатель преломления hi) (рис. 7.8-18), можно видеть, что прохождение сопровождается серией полных
Рис. 7.8-18. Диаграмма прохождения света через «толстую» пленку (а) и «тонкую» пленку световода (б). 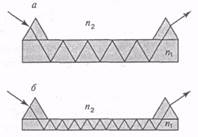
внутренних отражений. Когда п\ > П2, то, согласно закону Снелла,
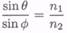 (7.8-32)
(7.8-32)
где в — угол падения, а ф — угол пропускания. Когда sin в > n^/rii, не существует действительного решения для ф, угол пропускания представляет собой комплексное число, и это отвечает условиям полного внутреннего отражения. Проходящая волна представляет собой затухающую волну, нормальную (ось z) к поверхности (ось х) с напряженностью электрического поля Е, которая описывается выражением
'

где остается только ^-составляющая (при других условиях электрическое поле будет включать также ж-составляющую), так что поле спадает в направлении z с глубиной проникновения dp:
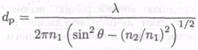 (7.8-33)
(7.8-33)
из чего следует, что ослабление сигнала максимально у поверхности и равно нулю в объеме.
На практике это означает, что имеется «зона детектирования» у поверхности и «мертвая зона» в объеме. Хотя такая конфигурация имеет то преимущество, что свет не проходит через объем пробы, она имеет и недостаток, заключающийся в том, что взаимодействие между светом и реагентами, иммобилизованными на поверхности, в обычном многомодовом световоде меньше, чем с реагентами в объеме раствора. Рассматривая лучевую модель прохождения света через световод, можно видеть, что взаимодействие с поверхностью происходит только в N «точках» полного внутреннего отражения внутри световода (см. рис. 7.8-18). N определяется уравнением
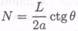 (7.8-34)
(7.8-34)
где L — длина, 2а —толщина пленки.
П «Зона детектирования» расположена на поверхности световода.
Тонкопленочные световоды увеличивают взаимодействие, потому что величина а меньше [7.8-52], но производить их непросто. Одним из решений служит ионный обмен на поверхности предметного стекла, дающий слой с высоким показателем преломления. Другое решение — использование низкотемпературных фосфатных стекол. Толстопленочные световоды относительно просты в изготовлении и служат недорогим материалом для сенсоров. Тем не менее, использование подходящих тонкопленочных световодов во многих случаях предпочтительнее, так как позволяет преобразовать устройства внешнего режима во внутренние оптические устройства.
Не нашли, что искали? Воспользуйтесь поиском: