
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Гомогенные и гетерогенные системы. Скорость гомогенных и гетерогенных реакций. Зависимость скорости реакции от концентрации реагирующих веществ. Зависимость скорости реакции от температуры. Химическое равновесие. Константа равновесия. Принцип Ле Шателье.
Химическая кинетика изучает скорость химических процессов, которые могут протекать в гомогенной или гетерогенной системах.
Система – вещество или совокупность веществ, реально или мысленно отделенных от окружающей среды.
Гомогенная система – система, состоящая из одной фазы (например, водный раствор хлорида натрия). Отсутствует граница раздела между веществами.
Гетерогенная система – система, состоящая из нескольких фаз (например, смесь воды и масла). Вещества имеют между собой границу раздела.
Скорость гомогенной реакции – количество вещества, вступившего в реакцию или образующегося при реакции за единицу времени, в единице объёма системы

Скорость гетерогенной реакции – количество вещества, вступившего в реакцию или образующегося при реакции за единицу времени на единице площади раздела фаз

где ∆n – изменение количества вещества
∆t – время реакции
V – объём гомогенной системы
S – площадь раздела фаз в гетерогенной системе
Зависимость скорости реакции от концентрации реагирующих веществ отражена в законе действующих масс: «при постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ в степенях соответствующих им стехиометрическим коэффициентам».
Например, для реакции:
2SO2(Г) + O2(Г) ↔ 2SO3(Г)
скорость прямой реакции выражается уравнением:
 - кинетическое уравнение реакции,
- кинетическое уравнение реакции,
где [SO2], [O2]– концентрации SO2 и O2
К- константа скорости прямой реакции;
скорость обратной реакции: 
Физический смысл константы скорости в том, что при концентрации веществ равных единице V = K, т.е. константа скорости характеризует скорость химического процесса и зависит только от природы реагирующих веществ и температуры.
Для гетерогенных систем в уравнение зависимости (кинетическое уравнение) входят концентрации только тех веществ, которые находятся в растворенном или газообразном состоянии, так как для твёрдых веществ концентрация вещества на поверхности остается постоянной.
Например, для реакции:
С(ТВ) + О2(Г) = СО2(Г)
Кинетическое уравнение запишется:
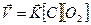 , но т.к. [C] = const
, но т.к. [C] = const
 , где
, где  ЭФ=
ЭФ=  [C]
[C]
Зависимость скорости реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
 ,
,
где  – температурный коэффициент
– температурный коэффициент
Vt2,Vt1 -скорости реакции при температуре t2 и t1
Пример 1. Вычислить, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 500 до 800С, если температурный коэффициент реакции равен 3


Следовательно, скорость реакции возрастёт в 27 раз.
Пример 2. Во сколько раз изменится скорость прямой реакции при уменьшении объёма в 4 раза в системе:
2СО(г) + О2(г) = 2СО2(г)
Кинетическое уравнение прямой реакции:

Система гомогенная и газофазная, поэтому при уменьшении объёма в системе в 4 раза, концентрация каждого из реагирующих веществ увеличится в 4 раза. При новых концентрациях кинетическое уравнение:

Отсюда  = 64
= 64
Следовательно, скорость прямой реакции возрастёт в 64 раза.
В большинстве случаев химические реакции протекают как в прямом, так и в обратном направлениях (обратимые реакции). В обратимых процессах прямая и обратная реакция протекают одновременно в противоположных направлениях.
Например, для реакции:
СО(Г) + Н2О(Г) = СО2(г) + Н2(г)
Кинетическое уравнение для прямой реакции:

Кинетическое уравнение для обратной реакции:

Состояние, при котором скорости прямой и обратной реакции равны ( ), называется состоянием химического равновесия. При химическом равновесии обе реакции продолжают протекать, и в системе при этом присутствуют и реагенты, и продукты
), называется состоянием химического равновесия. При химическом равновесии обе реакции продолжают протекать, и в системе при этом присутствуют и реагенты, и продукты
 =
= 
 ,
,
где K-константа равновесия;
[CO2], [H2], [CO], [H2O]– равновесные концентрации веществ в системе.
Если К>1, в системе преобладают продукты – равновесие смещено в сторону прямой реакции.
Если К<1, в системе преобладают реагенты – равновесие смещено в сторону обратной реакции.
Состояние химического равновесия зависит от:
- концентрации веществ;
- температуры системы;
- давления системы (для газофазных реагентов и продуктов).
При изменении параметров системы нарушается состояние химического равновесия. Переход системы из одного равновесного состояния в другое называется смещением химического равновесия.
Направление смещения химического равновесия определяется принципом Ле Шателье: «если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдёт в другое состояние равновесия так, чтобы уменьшить эффект внешнего воздействия».
Пример 3. Экзотермическая реакция сгорания водорода в кислородепротекает по уравнению:
2Н2(г) + О2(г) = 2Н2О(г) ∆Н<0
Как надо изменить а) температуру; б) концентрацию исходных веществ; в) давление, чтобы сместить равновесие в сторону прямой реакции?
Из принципа Ле Шателье следует, что смещение равновесия достигается:
а) увеличением концентрации исходных веществ;
б) понижением температуры системы, так как прямая реакция идёт с выделением тепла (нагревом системы);
в) увеличением давления в системе, так как прямая реакция идёт с уменьшением давления (из трёх моль газа образуется два моль газообразных продуктов).
Не нашли, что искали? Воспользуйтесь поиском: