
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Анализ фазовых превращений в двойных сплавах с неограниченной растворимостью компонентов в жидком и твёрдом состояниях
АНАЛИЗ ФАЗОВЫХ ПРЕВРАЩЕНИЙ
В ДВУХКОМПОНЕНТНЫХ СПЛАВАХ
Методические указания к практическим занятиям
по дисциплине «Теория строения материалов»
для студентов всех специальностей
всех форм обучения
Нижний Новгород 2014
Составители: Сорокин В.К., Беляев Е.С., Воскресенская Т.А., Романов А.С.
УДК 621.002.3
Анализ фазовых превращений в двухкомпонентных сплавах: метод. указания к практическим занятиям для студентов всех специальностей всех форм обучения/ НГТУ; сост.: Сорокин В.К., Беляев Е.С., Воскресенская Т.А., Романов А.С. - Н.Новгород, 2014.- 30 с.
Научный редактор С.В. Костромин
Редактор Э.Б. Абросимова
Подп. в печ. 14.07.14. Формат 60х84 1/16. Бумага газетная. Печать офсетная. Печ.л. 1,9 Уч.-изд.л. 1,1. Тираж 300 экз. Заказ
Нижегородский государственный технический университет им. Р.Е. Алексеева.
Типография НГТУ. 603950, Н.Новгород, ул. Минина, 24.
© Нижегородский государственный
технический университет, 2014
Общие сведения
Анализ фазовых превращений в металлических сплавах проводится в следующем порядке:
1) начертить диаграмму фазового равновесия заданной системы, обозначить буквами характерные течки и указать фазы во всех фазовых областях;
2) описать, к какому типу относится диаграмма фазового равновесия и указать трёхфазные превращения, имеющие место в системе;
3) подсчитать число степеней свободы во всех фазовых областях для заданного сплава X;
4) по указанию преподавателя определить темп кристаллизации для сплава X;
5) начертить кривую охлаждения сплава Х с учётом темпа кристаллизации в интервале между температурами ликвидуса и солидуса;
6) подчитать по правилу отрезков массы равновесных фаз и массы структурных составляющих при комнатной температуре, исходя из 100 кг первоначального расплава;
7) записать все фазовые превращения при охлаждении сплава Х;
8) зарисовать схемы изменения микроструктуры для сплава Х при охлаждении до комнатной температуры.
Для понимания фазовых превращений необходимо знание основных представлений, используемых при анализе диаграмм состояния.
Простые и сложные вещества, выделенные из окружающего мира реально существующими или воображаемыми поверхностями, называют термодинамической системой. Система характеризуется рядом присущих ей термодинамических параметров: температурой, давлением, концентрацией и др. Совокупность параметров определяет состояние системы. Система может быть гомогенной (однородной), если состав и свойства однаковы во всех точках, и гетерогенной (неоднородной), если она состоит из нескольких фаз. Под фазой поиимают совокупность материальных частей системы, обладающих одинаковым или непрерывно от точки к точке изменяющимися термодинамическими параметрами. Фазы отделены одна от другой поверхностями раздела, где параметры изменяются скачком.
Такое состояние системы, при которое все термодинамические параметры имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго, называется равновесным. Система самопроизвольно переходит в состояние равновесия при неизменных внешних условиях. Установление равновесного состояния системы произойдет, когда свободная энергия системы достигнет минимального значения (рис. 1).
Вещества, минимально необходимые для составления данной системы, называются компонентами. При определенных условиях разные фазы одного и того же вещества могут находиться в равновесии друг с другом, соприкасаясь между собой. Равновесие фаз имеет место лишь при определенных значениях параметров системы. Число термодинамических параметров системы, которые могут изменяться независимо друг от друга без нарушения равновесия фаз и изменения числа фаз, называется числом степеней свободы системы или ее вариантностью. Между числом компонентов К, числом равровесных фаз Ф и вариантностью системы С существует аналитическая зависимость, называемая правилом фаз Гиббса. При постоянном давлении С = К – Ф + 1, т.е. число степеней свободы равно разности между числом компонентов и числом фаз плюс один.
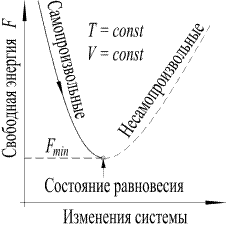
Рис.1
Переход из одной фазы в другую, которые характеризуются изменением объёма и тепловыми эффектами, называются фазовыми переходами I-го рода. К ним относятся превращения твёрдого тела в жидкость, жидкости в пар и т.д. Состояние каждой фазы в системе, состоящей из двух компонентов, может быть изображена геометрически точкой на плоскости, координатами которой служат температура и концентрация (рис. 2). За концентрацию принимается отношение массы одного из компонентов в данной фазе к массе всей фазы. Прямая АВ, отложенная на оси абсцисс, характеризует концентрацию компонентов от 0 до 100%. Конечные точки А и В соответствуют компонентам.
Графически выраженная, зависимость Т-х между значениями переменных, определяющих состояние системы (температура, концентрация), представляет собой диаграмму состояния системы или диаграмму фазового равновесия. Каждая точка в системе координат Т - х соответствует определенному состоянию системы и называется фигуративной. Процесс нагревания или охлаждения сплава графически изображается перемещением точки, соответствующей данному сплаву, вверх или вниз по вертикали. Переход сплава из одного состояния в другое отмечается точками, а совокупность таких точек даёт линии, разделяющие диаграмму состояния на отдельные поля (области). Каждая область диаграммы охватывает все возможные сочетания температур и концентраций, отвечающих равновесному существованию определённой фазы или фаз.
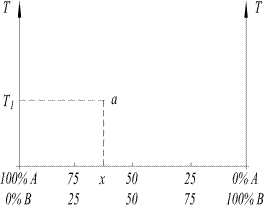
Рис. 2
Анализ фазовых превращений в двойных сплавах с неограниченной растворимостью компонентов в жидком и твёрдом состояниях
Диаграмма фазового равновесия для рассматриваемого случая представлена на рис. 3.
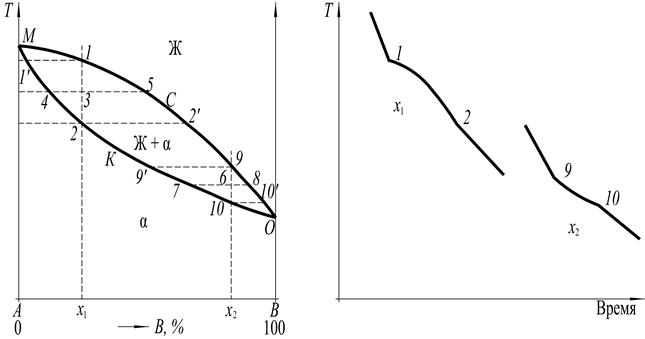
Рис. 3
Как видно, в диаграмме фазового равновесия наблюдается три области состояний: область гомогенного жидкого раствора «Ж» выше линии МСО, область гомогенного твёрдого раствора, обозначенного греческой буквой α, ниже линии МКО и область двухфазного раствора «Ж + α» между линиями МСО и МКО.
Линия МСО представляет собой геометрическое место точек температур начала кристаллизации (или конца плавления) твёрдой фазы α и называется линией ликвидус. Геометрическое место точек температур конца кристаллизации (или начала плавления) твёрдой фазы есть линия МКО, называемая линией солидус.
Выше линии ликвидус жидкий раствор является ненасыщенным, т.е. в нём ещё может раствориться добавочное количество компонентов. На линии ликвидус жидкий раствор становится насыщенным, т.е. таким, в котором компонент при данной температуре уже в большем количестве не растворяется. Ниже линии ликвидус сплавы переходят в двухфазную область «жидкий раствор + твёрдый раствор». Следовательно, линия ликвидус представляет собой геометрическое место точек концентраций жидкого раствора, находящегося в равновесии с твёрдым раствором.
Аналогично линия солидус характеризует концентрацию твёрдого раствора, находящегося в равновесии с жидким раствором. Ниже линии солидус МКО находится область ненасыщенного твёрдого раствора.
Так, для сплава Х 1 при температуре Т 3 фигуративной точке 3 системы отвечают на горизонтальной линии фигуративной точке 4 (солидус) и 5 (ликвидус), находящихся в равновесии соответственно твёрдой фазы α и жидкой фазы Ж. Следовательно, концентрация твёрдой фазы выражается точкой 4, а равновесной с ней жидкой фазы – точкой 5.
Фигуративные точки, выражающие концентрации двух равновесных фаз, называются сопряжёнными точками, а кривые, образованные рядами этих точек, называются сопряжённымикривыми. Изотермы, соединяющие фигуративные точки двух фаз, находящихся в равновесии (т.е. сопряжённые точки), называются конодами. Для рассмотренного примера конодой будет линия 4-5. Следовательно, при температурах Т 1 и Т 2 конодами будут линии 1’-1 и 2-2’.
Соотношение количеств находящихся в равновесии фаз определяется правилом отрезков (или рычага):
 ,
,
т.е. массы фаз, находящиеся в соотношении, обратно пропорциональны отрезкам, на которые фигуративная точка 3 делит изотерму (коноду), соединяющую сопряжённые точки 4 и 5.
Массу каждой отдельно взятой фазы можно определить из следующих соотношений:

т.е. для определения количества жидкой фазы необходимо взять отношение длины отрезка 4-3, примыкающего к области твёрдой фазы, к длине коноды 4-5; для подсчёта твёрдой фазы берётся отношение длины отрезка 3-5, примыкающего к области жидкой фазы к длине коноды 4-5.
Рассмотрим фазовые превращения, происходящие в рассматриваемой системе, на примере охлаждения сплава состава Х 1. Выше точки 1 сплав находился в области однофазного ненасыщенного жидкого раствоpa. Применяя правило фаз, будем иметь для однофазной области «Ж» число степеней свободы:
СЖ = К – Ф + 1 = 2 – 1 + 1 = 2.
Так как С = 2, то возможно в пределах области жидкой фазы, выше линии ликвидус МСК, изменять произвольно по нашему выбору, одновременно температуру и концентрацию, не нарушая равновесного однофазного состояния системы. Геометрически это означает, что фигуративная точка может быть смещена в любом направлении в области выше линии ликвидус МСК.
В интервале температур Т 1- Т 2 сплав находится в двухфазной области «жидкий раствор + твердый раствор» и число степеней свободы по правилу фаз равно:
СЖ+α = К – Ф + 1 = 2 – 2 + 1 = 1.
При С = 1 допустимо произвольно изменять только один параметр состояния: температуру или концентрацию одного из компонентов. Геометрически это значит, что фигуративная точка в области между МСО и МКО может быть смещена или по вертикали (шкала температур) без изменения состава сплава, или по изотерме, когда изменяется состав сплава при постоянной температуре. Каждой температуре отвечает новая, строго определенная концентрация жидкой и находящейся с ней в равновесии твердой фазы.
При температуре ниже точки 2 сплав находится в области однофазного ненасыщенного твердого раствора и число степеней свободы:
Сα = К – Ф + 1 = 2 – 1 + 1 = 2.
Следовательно, возможно одновременно изменять температуру и концентрацию, сохраняя равновесное состояние системы.
Далее построим кривую охлаждения сплава состава Х 1. В соответствии с правилом фаз кристаллизация твердого раствора происходит в некотором интервале температур T 1- Т 2, называемой интервалом кристаллизации (С = К – Ф + 1 = 2 – 2 +1 = 1), и на кривой охлаждения будут две критических точки 1 и 2 (см. рис. 3). Ход кривой охлаждения в интервале температур между точками ликвидуса 1 и солидуса 2 зависит от темпа (интенсивности) кристаллизации. Темп кристаллизации характеризует увеличение в сплаве количества кристаллов при понижении температуры, т.е. скорость кристаллизации по температуре (производная массы по температуре dM / dT). Для сплавов различного химического состава при понижении температуры на одинаковую долю интервала кристаллизации (например, на 1/2 этого интервала) кристаллизуется различное количество всей массы сплава и характер кривых охлаждения будет различен.
Так, для сплава X 1 количество твердой фазы при Т 3 (1-3 = 3-2) определяется по правилу отрезков следующим отношением:

В этом сплаве в начальной стадии кристаллизации приращение массы твердой фазы изменяется с понижением температуры очень значительно, поэтому на кривой охлаждения четко выявляется точка ликвидуса 1; в интервале температур Т 1- Т 2 кривая охлаждения является выпуклой (рис. 3).
У сплава Х 2 количество твердой фазы при T 6 (9-6 = 6-10):
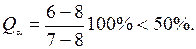
Приращение массы в начальный период кристаллизации незначительное, точка ликвидус 9 выявляется нечетко и кривая охлаждения в интервале температур Т 4- Т 5 является вогнутой.
После построения кривой охлаждения рассмотрим процессы, происходящие при охлаждении сплава состава X 1. Выше температуры ликвидуса T 1 сплав находится в области однофазного ненасыщенного жидкого раствора. При T 1 жидкий раствор становится насыщенным.
Ниже T 1 начинается фазовый переход жидкой фазы в твердую (твердый раствор), который заканчивается при температуре солидуса T 2. Концентрация жидкой и твердой фазы изменяется при этом по сопряженным кривым 1 - 2’ и 1’ - 2, соответственно. Следовательно, концентрация жидкой фазы меняется по отрезку 1 - 2’ кривой ликвидуса, а твердой фазы – по отрезку 1’ - 2 кривой солидуса.
Процесс фазового перехода записывают следующим образом:
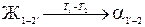 .
.
В левой части записывается исходная фаза, а в правой – конечная. Стрелка означает фазовый переход, a T 1 и Т 2 над стрелкой – температуры начала и конца фазового перехода, а индексы 1’-2 фазы в левой части показывают изменение концентрации исходной фазы в интервале температур Т 1 – Т 2 фазового перехода, а индексы 1’-2 фазы α в правой части – соответственно изменение концентрации конечной фазы.
Представленная запись читается так: жидкая фаза в интервале температур Т 1- Т 2 переходит в твёрдую фазу α, причём концентрация жидкой фазы изменяется по линии 1-2’, а твёрдой фазы – по линии 1’-2.
Ниже температуры солидуса Т 2 происходит охлаждение однофазного ненасыщенного твёрдого раствора. Аналогично анализируется процесс фазового перехода и для сплава состава Х 2.
Не нашли, что искали? Воспользуйтесь поиском: