
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Анализ фазовых превращений в двойных сплавах с полной растворимостью компонентов в жидком состоянии и ограниченной растворимостью в твёрдом состоянии
Такие диаграммы фазового равновесия являются наиболее распространенными. Они подразделяются на системы с перитектическим и эвтектическим превращениями.
Диаграмма фазового равновесия с ограниченной растворимостью компонентов в твердом состоянии и наличием перитектическсго превращения представлена на рис. 4.
Как видно, на диаграмме фазового равновесия имеется три однофазных области и три двухфазных области. Выше линии ликвидус СРК – расположена область ненасыщенного жидкого раствора Ж. Ниже линии СМ (солидус) находится область твердого раствора компонента В в компоненте А, обозначенного буквой α; растворимость В в А ограничена линией МА, называемой линией предельнойрастворимости (пли линией насыщения).

Рис. 4
Ниже линии ОК (солидус) расположена область твердого раствора компонента А в компоненте В, обозначенного буквой β. Предельная растворимость этого твердого раствора ограничена линией ОВ.
При температуре ТМОР происходит перитектическое превращение:
 ,
,
т.е. жидкая фаза концентрации точки перитектики Р взаимодействует (реагирует) с ранее образовавшимся твёрдым раствором α, концентрации точки М; в результате этой реакции образуются новые кристаллы твёрдого раствора β концентраций точки О. Характерной особенностью перитектического превращения является то, что жидкая фаза находится в равновесии с двумя твёрдыми фазами, которые обогащены одним и тем же компонентом по сравнению с жидкой фазой.
В соответствии с правилом фаз при трёхфазном равновесии в двух-компонентной системе число степеней свободы равно нулю:
С = К – Ф + 1 = 2 – 3 + 1 = 0.
Следовательно, в случае трёхфазного равновесия температура и концентрация фаз не могут меняться; на кривой охлаждения будет наблюдаться горизонтальная температурная остановка. Горизонтальная изотермическая линия МОР на диаграмме, фазового равновесия является фазовой областью при постоянной температуре перитектического превращения, на которой в равновесии находится три фазы: Ж; α; β. Линия МОР одновременно является и линией солидус. Рассмотрим фазовые превращения, происходящие при охлаждении в рассматриваемой системе, на примере сплавов составов Х 1, Х 2, Х 3.
Сначала рассмотрим сплав Х 2. Схема превращений запишется следующим образом:


В этом сплаве соотношение количеств жидкой фазы и твёрдой фазы α в начале перитектического превращения (точка 4 на диаграмме фазового равновесия) равно:
 .
.
Такое соотношение точно соответствует полному перитектическому превращению в твёрдый раствор β, поэтому ниже Т 4 сплав находится в однофазной области ненасыщенного β-твердого раствора.
Для сплава X 1 в начале перитектического превращения (точка 2) имеем:
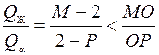 ,
,
т.е. жидкая фаза исчезает раньше, чем прореагируют все кристаллы твёрдой фазы α, Схема превращений будет следующая:
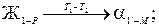

Ниже температуры Т 2 сплав X 1 находится в двухфазной области.
В сплаве Х 3 соотношение жидкой и твёрдой фаз в начале перитектического превращения (точка 6) выражается соотношением:
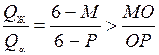 ,
,
следовательно, в конце перитектического превращения в избытке остается жидкая фаза, которая при дальнейшем охлаждении в интервале температур T 6 – Т 7 переходит в твердый раствор β. Для сплава Х 3 будут наблюдаться следующие фазовые переходы:



Диаграмма фазового равновесия с ограниченной растворимостью компонентов в твёрдом состоянии и наличием эвтектического превращения дана на рис. 5.
Выше линии ликвидус АЕВ находится однофазная область ненасыщенного жидкого раствора. Ниже линии AM (солидус) расположена однофазная область твёрдого раствора α, которая ограничена линией предельной растворимости МО.
Ниже линии ВК (солидус) находится однофазная область твёрдого раствора β, ограниченная линией предельной растворимости КС.
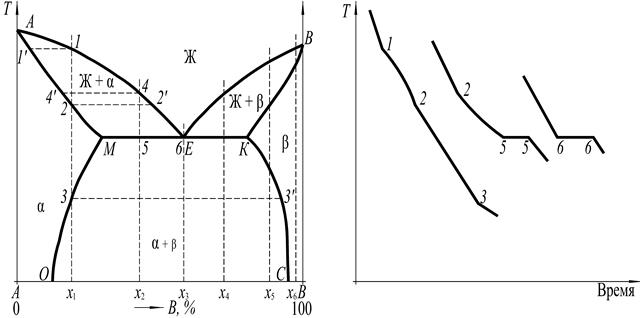
Рис. 5
При температуре ТМЕК происходит эвтектическое превращение:

т.е. жидкая фаза концентрации эвтектической точки Е кристаллизуется с образованием двух твёрдых фаз: твёрдого раствора α концентрации точки М, и твёрдого раствора β концентрации точки К. Характерной особенностью эвтектического превращения является то, что жидкая фаза находится в равновесии с двумя твёрдыми фазами, одна из которых обогащена по сравнению с жидкой фазой первым компонентом, а вторая обогащена другим компонентом.
По правилу фаз при трёхфазном равновесии число степеней свободы равно нулю:
С = К – Ф + 1 =2 – 3 + 1 = 0,
т.е. температура и концентрация фаз в течение всего превращения остаются постоянными.
На диаграмме фазового равновесия изотермическая линия МЕК является трёхфазной областью, на которой в равновесии находятся фазы α и β. Эта линия одновременно является линией солидус.
Рассмотрим процессы фазовых переходов при охлаждении сплавов Х 1, Х 2, Х 3.
В сплаве Х 3 эвтектического состава при Т 6 происходит эвтектическое превращение:
 .
.
При температуре ниже T 6 в связи с изменением предельной растворимости компонентов в твёрдых растворах α и β происходят одновременно следующие фазовые переходы:

где Т К – комнатная температура.
В сплаве Х 2 идут следующие превращения:
 .
.
Соотношение количества жидкой и твёрдой фаз в конце кристаллизации твёрдого раствора α (температура Т 5) определяется следующим образом:
 .
.
Количество жидкой фазы соответственно равно:
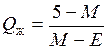 .
.
Эта жидкая фаза концентрации эвтектической точки Е при Т 5 превращается в смесь двух твёрдых растворов:
 .
.
В связи с уменьшением растворимости компонентов в твёрдых растворах ниже Т 5 идут следующие фазовые превращения:

Фазовые переходы для сплава Х 1, даны ниже:
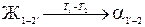 ;
;

Диаграммы фазового равновесия, представляя собой совокупность областей устойчивости и равновесия фаз, характеризуют фазовое состояние сплавов в равновесных условиях. В диаграммах фазового равновесия не учитываются размеры, форма и взаимная ориентировка отдельных фаз, поэтому детальные сведения о микроструктуре сплавов в равновесном состоянии из диаграммы состояния получить невозможно. Качественная характеристика ожидаемой микроструктуры в условиях, близких к равновесным, может быть дана по диаграмме фазового равновесия, исходя из последовательных фазовых переходов при охлаждении и нагреве сплавов.
Подробные сведения о микроструктуре возможно получить только на основании микроструктурного анализа сплавов с помощью металлографического микроскопа. Микроструктура сплавов для случая ограниченной растворимости компонентов в твёрдом состоянии с наличием эвтектического превращения представлена на рис. 6.
Как видно, микроструктура сплава Х 1 состоит из зёрен твёрдого раствора α и избыточных (вторичных) кристаллов твёрдого раствора β. Сплава Х 2 имеет микроструктуру из кристаллов твёрдого раствора α и эвтектики α+β. Эвтектика представляет собой смесь двух твёрдых фаз и имеет пластинчатое, зернистое или скелетное строение. Эвтектика образуется в результате эвтектического превращения:
 .
.
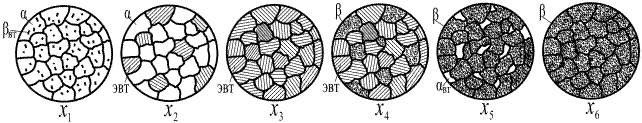
Рис. 6
Сплав Х 3, называемый эвтектическим, имеет микроструктуру эвтектики. В сплаве Х 4 наблюдается структура из кристаллов твёрдого раствора β и эвтектики, в сплаве Х 5 – из зёрен твёрдого раствора β и избыточных (вторичных) кристаллов твёрдого раствора α. Микроструктура сплава Х 6 состоит из зёрен твёрдого раствора β.
Отдельные структурно обособленные части (элементы) микроструктуры сплавов, которые при рассмотрении под микроскопом имеют своё характерное строение, называются структурными составляющими сплавов. Так, в сплаве Х 2 структурными составляющими являются кристаллы твёрдого раствора α и эвтектика, в сплаве Х 3 – одна структурная составляющая (эвтектика).
В ряде случаев данные о структурных составляющих, полученные путем микроструктурного анализа, указываются на диаграмме фазового равновесия в виде структурных областей, разделенных пунктирными вертикальными линиями. Диаграмма фазового равновесия с обозначением структурных областей по данным микроструктурного анализа приведена на рис. 7, а. Сплавы, находящиеся по составу между точками М и Е, называются доэвтектическими, а между Е и К – заэвтектическими.
Количество структурных составляющих в сплавах можно подсчитать по правилу отрезков. Так, в сплаве Х 2 (см. рис. 7) количество эвтектики равно:
 ,
,
а количество второй структурной составляющей – кристаллов твёрдого раствора α определяется из следующего соотношения:
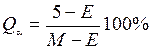 .
.
Данные об изменении количества структурных составляющих в зависимости от химического состава сплава при заданной температуре иногда представляют в виде структурной диаграммы (рис. 7, б).
Не нашли, что искали? Воспользуйтесь поиском: