
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Окислительно-восстановительные потенциалы
Окислительно-восстановительный потенциал системы, содержащей окисленную и восстановленную формы элемента, определяется по уравнению Нернста:
Е = Е0 +  lg C,
lg C,
где n - число электронов, участвующих в процессе; Е° — стандартный потенциал, В; С – концентрация ионов металла в растворе, моль×л-1
Пример 1. Определить электродный потенциал, возникающий на алюминии, опущенном в 0,001 М раствор сульфата алюминия.
Решение. Для алюминиевого электрода стандартный электродный потенциал Е0 = - 1,66 В. Стандартные электродные потенциалы имеются в рекомендуемых учебниках или пособии кафедры «Химия»: № 1639 «Справочный материал» авторов Васильченко Л.М., Сеницкой Г.Б., Халиковой А.В., Сотовой Н.В.
По формуле Нернста вычисляем электродный потенциалы алюминия с учетом концентрации электролита:

 Е Al3+/Al= E0Al3+/Al +
Е Al3+/Al= E0Al3+/Al + 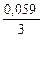 lg 0,001 = -1,66 + 0,0196×(-3) = -1,72 В
lg 0,001 = -1,66 + 0,0196×(-3) = -1,72 В
Пример 2. Рассчитать водородный электронный потенциал в среде с рН = 4.
Для стандартного водородного электрода Е0 = 0, n = 1, отсюда уравнение Нернста принимает вид:
ЕН+/H = 0,059lg [H+], pH – lg[Н+],
поэтому Е Н+/Н = -0,059 рН.
Расчет: Е Н+/Н = -0,059 · 4 = - 0,236 В.
Не нашли, что искали? Воспользуйтесь поиском: