
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
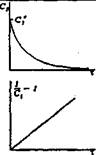
Кинетическое уравнение
График зависимости С ort
|
Мономодехулярная
Реакция
Го порядка
А,-*-> *А+...
Реакция
2—го порядка 2А,±* VA+-
C.-CJ.-
Кт ■ 1/С, - 1
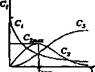
 Параллвльна»
Параллвльна»
Реакция
А,** А,
С, - Cf e-l»i*4b
С,» C'+k/lk.+k,) С|*11-е"и,*ь*1
с, = c'+v(k,+k^) с;|1-в-,ь,**»1ч
,С, С,
|
4. Последовательная реакция А,*»-». А,*-». А,
С, = С' е"*|' при С'= 0 и С^= 0 С, - к,/(ку-к,) (е'"-е-Ч') С, - t - (к, е-к"+ к, e-'i'l/lk.-k,) *.„ = 0» «■ " '» к,) ("с," «J сь— я 1«/*.) к,/(к,-к,)
- в основе процессов термолиза нефтяного сырья лежат реакции крекинга (распада) и поликонденсации (синтеза), протекающие через ряд промежуточных стадий по радикально-цепному механизму;
- в реакциях крекинга ведущими являются короткоживущие радикалы алкильного типа, а поликонденсации - долгоживущие бен-зильные или фенильные радикалы.
Свойства и реакции радикалов. Радикалы, имеющие неспарен-ные (свободные) электроны, образуются при гемолитическом распаде углеводородов преимущественно путем разрыва менее прочной С-С-связи: С2Н6 —> 2 СН3, а также С-Н-связи: С^-» Н- +С2Н5.
Гемолитический распад молекул энергетически значительно выгоднее, чем гетеролитический с образованием заряженных ионов.
Радикалы, являясь химически ненасыщенными частицами, обладают исключительно высокой реакционной способностью и мгновенно вступают в различные реакции.
Радикалы высокой молекулярной массы термически малоста-бильны и распадаются с образованием низкомолекулярного более устойчивого радикала, в том числе водородного:
Р*. с4н,+сн, L-* csh10 + н..
При термолизе протекают следующие типы реакций радикалов.
1. Мономолекулярные реакции распада могут быть двух типов с образованием: 1) монорадикала и молекулы с двойной связью или 2)бирадикала:
1)R-->A + R-'; 2)R-»R'+R".
Из двух типов реакций энергетически более выгоден распад 1 типа. Бирадикалы при дальнейшем распаде образуют только молекулы с днойной связью и далее не участвуют в цепных реакциях термолиза.
Распад радикалов с образованием водородного радикала энергетически менее выгоден, чем образование алкильного радикала.
Если распад радикала возможен по двум путям с образованием в обоих случаях олефина и алкильного радикала, то энергетически более выгоден распад с образованием большего радикала. С перемещением свободной валентности ближе к центру радикала возрастает энергия, необходимая для его распада.
Наиболее вероятные направления радикалов те, которые требуют наименьшей энергии активации. Легче всего происходит распад С-С-связи в |3-положении к углероду, имеющему неспаренный электрон.
При распаде алкильных радикалов энергетически значительно выгоднее образование алкадиенов и водородного радикала СН2=СНСН2 —> СН2=С=СН2+Н-, чем образование бирадикала
сн2=сн-сн2 -+ сн2- + сн2=сн.
Распад нафтенового радикала с наибольшей скоростью проходит с раскрытием кольца, а не с отрывом водорода с кольца.
Бензильные радикалы малоактивны в реакциях распада, они склонны главным образом к реакциям рекомбинации и поликонденсации.
2. Реакции изомеризации. В процессах термолиза углеводеродов
могут происходить, кроме распада, и реакции структурной и скелет
ной изомеризации радикалов:
сн3~сн-сн2 -ь=5- сн2-сн-сн, <=^ сн3- сн~сн3,
сн, сн, сн2
сн сн
/ \\. / \\
НС СН НС СН
II I -* I I
Н2С —СН2 Н2С—СН2
3. Реакции замещения представляют собой по существу обмен
атомом водорода между радикалом (Н-, СН3 и С2Н5) (присоединяет)
и молекулой углеводорода (отдает):
R+RH->RH + R\
4. Реакции присоединения имеют место при взаимодействии ра
дикала с молекулой, имеющей двойную (то есть л) связь:
R- + CH2=CH-R' -> R-CH2-CH-R' (например, С2Н5 + С2Н4 —> С4Н,).
5. Реакция рекомбинации обратна реакции мономолекулярного
распада молекулы на радикалы:
R- + R-' -> RR'
(например, СН3 +С2Н5 —» С3Н8).
6. Реакция диспропорционирования радикалов является обрат
ной (обратимой) по отношению к реакции бимолекулярного их об
разования:
СН3 + С2Н5 -> СН4+ С2Н4, или 2С2Н5 -> С2Н4+ С2Н6.
Цепные реакции. Первичной реакцией термолиза нефтяного сырья является образование первичного радикала в результате мономолекулярного распада или бимолекулярного взаимодействия молекул углеводородов.
Концентрация радикалов в реакционной системе обычно невелика, и вероятность их столкновения между собой ничтожно мала. При термолизе более значительно преобладают взаимодействия между радикалом и молекулами исходного сырья. Поскольку радикал имеет свободный неспаренный электрон, то его реак-
ция с молекулами, все электроны которых спарены, должна в силу принципа неуничтожимости свободной валентности привести к образованию нового вторичного радикала. Если последний не является малоактивным, то он, в свою очередь, вступит в реакцию с новой молекулой сырья и т.д. Так как число радикалов, могущих образоваться при термолизе, велико, на некоторой стадии образуется радикал, принимавший участие в одной из предыдущих стадий, и возникает регулярное чередование двух или более последовательно параллельных элементарных реакций с образованием конечных продуктов. Этот процесс продолжится до тех пор, пока радикал не «погибнет» в результате реакций рекомбинации или диспропорционирования. Реакции такого типа называются цепными.
Первичная элементарная реакция с образованием первичного радикала из молекул сырья называется реакцией инициирования цепи. Реакции превращения одних радикалов в другие, при которых расходуется сырье, называются реакциями продолжения цепи. Реакции, при которых радикалы гибнут, превращаясь в стабильные молекулы в результате рекомбинации, диспропорционирования или образования малоактивного радикала, называются реакциями обрыва цепи. Обрыв цепи может произойти также при добавлении или присутствии в сырье веществ - ингибиторов, которые приводят к замене активных радикалов на малоактивные, не способные к продолжению цепи.
Совокупность элементарных реакций продолжения цепи, повторение которых дает цепной процесс, называют звеном цепи. В результате реакций обрыва цепи на каждый радикал, инициирующий цепной процесс, приходится некоторое конечное число звеньев, называемое длиной цепи.
Рассмотрим в качестве иллюстрации термический распад нормального пентана.
Инициирование цепи:
с,н„
| № | + £Н, |
| сн, | +.с,н, |
| Н- + | с,нп |
12 — 1908
Распад высокомолекулярных алкильных радикалов:
C5H12CSH,+ C2HS
с4н,+ сн3
с4н,
-*с,н4+с2н3 ^ с3н,+ сн,
->-С4Н,+ Н-
с,н7
С
с2н4+ сн3
с3н,+ н-
Продолжение цепи:
csh12 +
сн4+ с,ни с2н,+ csh„
Обрыв цепи:
| н- |
+ н- — + с,н.
сн3 +'c,ks
н,
с,н,
сн3 + сн3 -c,hs + с2н5
сн4 >• с,н, -> с4н„
Кроме невыраженных явно выше реакций, в процессе термолиза пентана протекают также реакции изомеризации, циклизации и далее поликонденсации с образованием высокомолекулярных ароматизированных продуктов.
Разветвленные цепные реакции - разновидность цепных реакций, в которых превращение активных промежуточных продуктов приводит к увеличению числа свободных радикалов. Например, одной из элементарных стадий окисления водорода является реакция
н+о2->6н+о.
В этой реакции вместо одной свободной валентности у атома водорода образуются три новые свободные валентности - одна у гидро-ксила и две (то есть бирадикал) у атома кислорода. Последующая
реакция бирадикала кислорода с молекулой водорода приводит к образованию двух новых свободных монорадикалов:
•О- + Н2 -> ОН + Н-.
Таким образом, одна цепь как бы разветвляется на три, откуда и происходит термин «разветвление». Примером такого механизма разветвления цепей являются, кроме горения водорода, реакции с участием перекисей углеводородов, например, детонационное горение автобензинов.
Не нашли, что искали? Воспользуйтесь поиском: