
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Удаление кислорода из воды.
Кислород, растворенный в воде, вызывает коррозию металла парогенераторов электростанций, трубопроводов станций и тепловых сетей, поэтому должен быть удален из воды. Удаление кислорода осуществляется деаэрацией и химическим восстановлением.
Деаэрация основана на использовании закона Генри, согласно которому растворимость газа прямо пропорциональна его давлению над жидкостью. Снижая парциальное давление газа над жидкостью, можно снизить растворимость его в жидкости. Парциальное давление можно снизить или уменьшением общего давления газа, или вытеснением данного газа другим газом. В практике используют оба приема. Обычно воду продувают водяным паром, при этом парциальное давление кислорода уменьшается. Однако методом деаэрации не удается обеспечить глубокое удаление кислорода. Последнее достигается взаимодействием кислорода с химическими восстановителями. Первоначально для этих целей использовался сульфит натрия, который при окислении переходит в сульфат натрия:
2Na2SO3 + О2 = 2Na2SO4
Этот метод и до сих пор применяется на станциях малой мощности. Однако при сульфитной обработке воды повышается солесодержание, что недопустимо на электростанциях, работающих при высоком давлении пара. На таких станциях кислород удаляют при помощи гидразина N2Н4,являющегося сильным восстановителем. При взаимодействии гидразина с кислородом образуются азот и вода по уравнению реакции
N2H4 + O2 = N2 + 2H2O
При этом солесодержание не меняется. К недостатку гидразина следует отнести его токсичность, поэтому при работе с ним должны соблюдаться соответствующие правила техники безопасности.
6.5.2. Умягчение воды методом осаждения.
Для малорастворимых солей при постоянной температуре соблюдается постоянство произведений активностей ионов, называемое произведением растворимости ПР. Например, при 20o С для равновесий
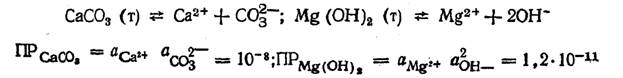
Концентрацию иона, входящего в малорастворимое соединение, можно уменьшить увеличением концентрации иона противоположного знака,входящего в то же соединение,например,концентрацию ионов Ca2+ и Mg2+ можно понизить увеличением концентрации ионов СО32- и ОН- соответственно. Этот принцип можно использовать для осаждения нежелательных примесей из раствора. Метод осаждения малорастворимых соединений применяется для очистки воды, например для ее умягчения (снижения жесткости). Для уменьшения карбонатной жесткости применяется метод известкования, при котором в обрабатываемую воду вводят известь Са(ОН)2. В результате электролитической диссоциации извести Са(ОН)2 = Са2+ + 20Н- возрастает рН воды, что приводит к смещению углекислотного равновесия в сторону образования карбонат-ионов:
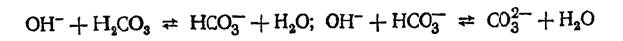
В результате этого достигается произведение растворимости карбоната кальция, и последний выпадает в осадок:
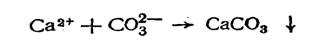
Кроме того, при увеличении концентрации гидроксил-ионов достигается произведение растворимости гидроксида магния, и последний выпадает в осадок Mg2+ + 20Н- = Mg(OH)2 .
Реакции, протекающие при введении извести, можно записать в молекулярной форме уравнениями

Как видно, при введении извести снижается концентрация ионов Са2+ и Mg2+ (умягчение), НCO3 (снижение щелочности) и H2CO3 .
Метод известкования непригоден для снижения некарбонатной жесткости. Для этих целей необходимо вводить хорошо растворимую соль, содержащую карбонат-ионы. Обычно для этого используют соду Na2CO3, которая, диссоциируя, дает ионы СО32-:
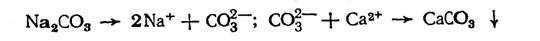
Углекислотное равновесие может быть смещено вправо и при нагревании:

В результате этого увеличивается концентрация карбонат-ионов и достигается произведение растворимости карбоната кальция, который выпадает в осадок. Такой метод умягчения называется термическим. Жесткость, удаляемая методом нагревания, называется временной жесткостью. Термический метод применяется только тогда, когда нет необходимости в глубоком смягчении и когда вода должна подогреваться по технологическому процессу.
Для очистки природных и сточных вод от примесей широко применяются методы катионирования, анионирования и химического обессоливания.
Ионный обмен.
Для удаления ионов из воды широко используется метод ионного обмена. Ионный обмен протекает на ионитах, представляющих собой твердые полиэлектролиты, у которых ионы одного знака заряда закреплены на твердой матрице, а ионы противоположного знака заряда способны переходить в раствор и заменяться на другие ионы того же знака заряда.
Способностью к ионному обмену обладают некоторые природные соединения, например алюмосиликаты. Однако более широкое применение получили синтетические ионообменники, которыми обычно служат полимерные материалы. В качестве примера полимеров, служащих основой (матрицей) для ионитов, можно назвать сополимеры стирола с дивинилбензолом и метакриловой кислоты с дивинилбензолом.Ионит состоит из матрицы, на которой имеется большое число функциональных групп. Последние или вводятся в мономер или в реакционную смесь при полимеризации, или прививаются к полимеру после полимеризации. Функциональные группы способны диссоциировать в растворе, при этом ионы одного знака заряда остаются на ионите, а ионы другого знака заряда переходят в раствор. В зависимости от того, какие ионы переходят в раствор, различают катиониты и аниониты.
У катионитов в раствор переходят катионы, которые затем могут обмениваться на катионы, находящиеся в растворе. Функциональными группами у катионитов обычно служат сульфогруппы —SO3H, фосфорнокислые группы —РО(ОН)2, карбоксильные группы —COOH, гидроксильные группы —ОН. При контакте ионита с раствором эти группы диссоциируют, посылая в раствор ионы Н+. В результате этого ионит заряжается отрицательно, раствор около ионита — положительно. В зависимости от степени диссоциации функциональных групп различают сильные и слабые катиониты. Катионит после диссоциации функциональных групп можно условно обозначать формулой Rn-nKt+, а ионный обмен представить уравнением
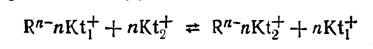
где Kt+1 и Kt+2 — катионы, участвующие в ионном обмене.
У анионитов функциональные группы при диссоциации посылают в раствор анионы, а на ионите остаются положительно заряженные ионы. Функциональными группами у анионитов обычно служат аминогруппы --NH2, =NH,-- N и четвертичные аммонийные основания —NR. При диссоциации этих групп ионит заряжается положительно, а раствор около ионита — отрицательно. Анионит после диссоциации функциональных групп можно обозначить формулой Rn+ nA-,а анионный обмен представить уравнением

A-1 иА-2—анионы, участвующие в ионном обмене. Аниониты также могут быть сильными и слабыми.
Не нашли, что искали? Воспользуйтесь поиском: