
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Якісні реакції на амінокислоти
Мета роботи: ознайомитися із будовою, хімічними властивостями та функціями білків в організмі людини. На прикладі реакцій осадження білків вивчити їхні фізико-хімічні властивості.
Питання для самопідготовки:
1. Будова амінокислот.
2. Замінні і незамінні амінокислоти.
3. Пептидний зв'язок.
4. Рівні організації білкової молекули.
5. Зворотна і незворотна денатурація білка.
ТЕОРЕТИЧНА ЧАСТИНА
Амінокислоти – структурні елементи, з яких побудовані білки.
У складі природних білків зустрічається 19 амінокислот (АК) та одна імінокислота. Усі амінокислоти, які входять до складу білків, являються амінопохідними карбонових кислот, у яких один атом водню в радикалі у α-вуглецевого атому заміщений на аміногрупу. Наприклад:

Усі амінокислоти об'єднані загальною ознакою — наявністю вільної карбоксильної групи та вільної незаміщеної аміногрупи в α-вуглецевому атомі. Виняток – про ін, у якого аміногрупа є частина піролідинового кільця. Поміж цих двох функціональних груп, кожна амінокислота має характерний тільки для неї радикал — R-групу. Таким чином, загальний тип будови а-амінокислот може бути представлений у вигляді наступної формули:
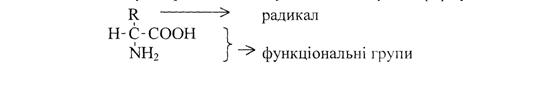
В залежності від природи радикалу відрізняють амінокислоти аліфатичного та циклічного рядів.
Деякі амінокислоти не можуть синтезуватися в організмі людини та повинні поступати разом із їжею. Їх називають незамінними та до них відносяться: валін, ізолейцин, лейцин, лізин, метіонін, треонін, триптофан, фенілаланін, тирозин, цистеїн.
Інші амінокислоти в організмі синтезуються та їх називають замінними: аланін, аспарагін, аспартат, гідроксилізин, гідроксипролін, гліцин, глутамат, глутамін, пролін, серін. До наполовину замінних відносяться: аргінін, гістидин.
Амінокислоти мають амфотерні властивості та можуть виступати у ролі як кислот, так і основ.
Повний (сумарний) заряд (алгебраїчна сума всіх позитивних та негативних зарядів) амінокислоти залежить від рН, тобто, від концентрації протонів в оточуючому розчині. Значення рН, при якому сумарний заряд амінокислоти дорівнює нулю і тому вона не переміщується у постійному електричному полі, називається її ізоелектричною крапкою.
ПРАКТИЧНА ЧАСТИНА
Мета роботи: Ознайомитися з якісними кольоровими реакціями на білки й амінокислоти.
Практичне значення роботи: Кольорові реакції широко використовуються для встановлення білкової природи речовини, вивчення амінокислотного складу різноманітних природних білків і пептидів, для ідентифікації індивідуальних амінокислот. Більшість із них чутливі і високоспецифічні, що дозволяє відкривати незначні кількості білків, тієї або іншої амінокислоти в гідролізатах білків, у біорідинах і тканинах організму, у лікарських засобах.
Матеріали і реактиви: Кольорові реакції на білки й амінокислоти проводять із: 1%-вий розчин яєчного білка, 10-% розчин їдкого натрію, 1%-вий розчин сульфату міді, 0,1%-вий розчин нінгідрину в 95%-вому ацетоні, концентрована азотна кислота, 10%-вий розчин ацетату свинцю, 10%-вий розчин гідроксиду натрію, волосся, 5%-вий розчин нітриту натрію, концентрована оцтова кислота; пробірки, піпетки, штатив для пробірок, пальник.
Хід роботи:
Дослід 1. Біуретова реакція (Піотровського) відкриває пептидний зв'язок (-CO-NH-) у білках.
Принцип методу. У лужному середовищі розчин білка при взаємодії з іонами міді набуває синьо-фіолетового кольору, а продукти його неповного гідролізу – пептони – дають рожеве забарвлення. Біуретову реакцію дають речовини, що містять не менше двох пептидних зв'язків.
Хід роботи. До 5 крапель 1%-вого розчину яєчного білка додають 5 крапель 10%-вого розчину їдкого натрію, 2 краплі 1%-вого розчину сульфату міді й усе перемішують. Вміст пробірки набуває фіолетового кольору. Не можна додавати надлишок сульфату міді, тому що синій осад гідрату окису міді маскує характерне фіолетове забарвлення біуретового комплексу білка.
Дослід 2. Нінгідринова реакція характерна для аміногруп, що знаходяться в α-положенні і входять до складу білків, поліпептидів і вільних амінокислот.
Принцип методу. α - амінокислоти при нагріванні з нінгідрином окислюються на альдегіди, оксид вуглецю (IV) і аміак. Аміак реагує з нінгідрином з утворенням комплексу, що має фіолетово-синій колір.
Хід роботи. До 3 - 4 крапель розчину білка додають 1 - 2 краплі розчину нінгідрину і нагрівають. У пробірці з'являється рожево-фіолетове забарвлення, що із часом синішає.
Дослід 3. Ксантопротеїнова реакція (Мульдера) доводить присутність у білках ароматичних амінокислот: триптофану, фенілаланіну, тирозину.
Принцип методу. При обробці розчину білка концентрованою азотною кислотою бензольне кільце амінокислот нітрується з утворенням нітросполук, забарвлених у жовтий колір.
Хід роботи. У пробірку до 3-4 крапель розчину білка додають 1-2 краплі азотної кислоти. Пробірку обережно нагрівають і стежать за зміною забарвлення.
Дослід 4. Реакція Фоля на амінокислоти, що містять сірку
Принцип методу. При нагріванні білка з лугом сірковмісні амінокислоти відщеплюють сірку у вигляді сірководню, що з ацетатом свинцю дає сірчистий свинець чорного кольору.
Хід роботи. В одну пробірку поміщають трохи волосся або шматочок нігтя, а в іншу – 5 крапель розчину білка. У кожну з пробірок додають по 1 краплі розчину (СН3СОО)2Рb, NaOH і нагрівають до кипіння.
Дослід 5. Визначення аміногрупи – NH2 в амінокислотах і білках (реакція Ван-Слайка).
Принцип методу. Азотиста кислота розкладає амінокислоти із звільненням газоподібного азоту.
Хід роботи. У пробірку наливають 3 - 5 мл розчину білка або амінокислоти, додають рівний об'єм розчину NaNО2 і декілька крапель концентрованої оцтової кислоти. При цьому утворюється азотиста кислота, що вступає в реакцію з аміногрупою. Виділяються бульбашки газу – азоту.
Результати дослідів заносять у таблицю такої форми:
Таблиця 3
Результати якісних кольорових реакцій на білки й амінокислоти
| № п/п | Назва реакції | Застосовувані реактиви | Поява фарбування | Що відкриває така реакція |
Зробити висновки.
Контрольні питання:
1. Що таке амінокислоти? Їх будова.
2. Як класифікуються амінокислоти?
3. Фізико-хімічні властивості амінокислот.
4. Які якісні реакції на амінокислоти Ви знаєте?
5. Напишіть формули таких амінокислот: гліцину, аланіну, цистеїну, серину, ізолейцину, аспарагінової та глутамінової кислоти, аргініну, фенілаланіну.
ЛАБОРАТОРНЕ ЗАНЯТТЯ № 5
Не нашли, что искали? Воспользуйтесь поиском: