
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
Так как молекулы электролитов в растворах распадаются на ионы, то и взаимодействия в растворах происходят между ионами.
Реакции, протекающие между ионами, называются ионными реакциями.
С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Рассмотрим реакции ионного обмена − взаимодействие между растворами двух солей, например:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
− это уравнение является молекулярным уравнением, так как формулы всех веществ записаны в виде молекул. Исходные вещества Na2SO4 и BaCl2 являются сильными электролитами; в растворе они находятся в виде ионов: (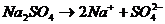 ,
,  ).
).
Сульфат бария (BaSO4) – труднорастворимая соль, выпадает в осадок, следовательно, ионы  и
и  уходят из раствора в виде соединения BaSO4.
уходят из раствора в виде соединения BaSO4.
Хлорид натрия (NaCl) – растворимая соль, сильный электролит, в растворе находится в виде ионов ( ).
).
С учетом диссоциации сильных электролитов уравнение реакции можно записать так:
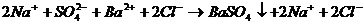 , такое уравнение называется полным ионным уравнением.
, такое уравнение называется полным ионным уравнением.
Ионы  и
и  имеются и в левой, и в правой частях уравнения, т.е. эти ионы в реакции участия не принимают, их можно исключить из уравнения реакции, тогда получим:
имеются и в левой, и в правой частях уравнения, т.е. эти ионы в реакции участия не принимают, их можно исключить из уравнения реакции, тогда получим:  ↓ − это уравнение называется кратким ионным уравнением. Оно показывает, что в ходе данной реакции происходит взаимодействие ионов
↓ − это уравнение называется кратким ионным уравнением. Оно показывает, что в ходе данной реакции происходит взаимодействие ионов  , которые находились в растворе Na2SO4, и ионов
, которые находились в растворе Na2SO4, и ионов  , которые находились в растворе BaCl2; в результате реакции образуется труднорастворимая соль BaSO4.
, которые находились в растворе BaCl2; в результате реакции образуется труднорастворимая соль BaSO4.
Необходимо помнить: в виде ионов в ионных уравнениях реакций записывают следующие соединения:
− сильные кислоты (HCl, H2SO4, HBr, HI, HClO3, HClO4, HMnO4, HNO3);
− сильные основания (KOH, NaOH, Ca(OH)2, Ba(OH)2 и др.);
− все растворимые в воде соли (смотрите таблицу растворимости).
В молекулярном виде записывают следующие соединения
− воду (Н2О);
− слабые кислоты (HNO2, HCN, H2CO3, CH3COOH, H2SO3 и др.);
− слабые основания (NH4OH, Mg(OH)2, и др. труднорастворимые основания; смотрите таблицу растворимости);
− труднорастворимые соли (↓) (AgCl, BaSO4, CaCO3, FeS и др; смотрите таблицу растворимости);
− амфотерные гидроксиды (↓) (Al(OH)3, Zn(OH)2, Cr(OH)3 и др.);
− газообразные вещества (CO2, SO2, H2, H2S, NH3 и др.);
− оксиды металлов и неметаллов (Na2O, CaO, P2O5, SiO2, B2O3 и др.).
− простые вещества (Cu, H2, I2 и др.);
− органические вещества – неэлектролиты (C2H5OH, C6H5Br и др.).
2 КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Все соединения делятся на неорганические и органические соединения. В настоящее время известно около 300 тыс. неорганических соединений. Неорганические соединения делятся на две большие группы:
Простые вещества;
Сложные вещества.
Простыми веществами называются вещества, молекулы которых состоят из атомов одного и того же элемента. Условные формулы простых веществ, состоят из одного атома элемента, например: С (углерод), из двух атомов элемента Н2 (водород), из трёх атомов элемента О3 (озон), из восьми атомов элемента S8 (сера) и т.д. Все простые вещества подразделяются на металлические и неметаллические вещества.
Металлическими веществами называются простые вещества, которые в химических реакциях проявляют свойства восстановителей (или восстановительные свойства), отдавая электроны, например: К, Fe, Zn и т.д.
Нужно помнить, что в химии есть исключения, например: Sn (олово) и Pb (свинец) могут принимать и отдавать электроны, они называются амфигенами.
Неметаллическими веществами называются простые вещества, которые в химических реакциях проявляют свойства, как окислителя, так и восстановителя, т.е. они способны как принимать, так и отдавать электроны (кроме простых веществ, образованных атомами элементов главной подгруппы восьмой группы).
Сложными веществами называют вещества, молекулы которых состоят из атомов двух или более элементов, например: H2O (из атомов двух элементов), H2SO4 (из атомов трёх элементов), KHCO3, KAl(SO4)2 (из атомов четырёх элементов) и т.д.
Сложные вещества делятся на четыре группы: оксиды, гидроксиды, соли, бинарные соединения.
Оксиды
Оксидами называются сложные вещества, молекулы которых состоят из атомов двух элементов, один из которых кислород в степени окисления (– 2), например: H2O, CuO, SO2 (при определении степени окисления знак «+» или «–» ставится перед цифрой, а при определении заряда, иона – после цифры).

 Оксиды
Оксиды 
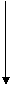

 Солеобразующие Соленеобразующие
Солеобразующие Соленеобразующие
Основные Амфотерные
Кислотные
Оксиды делятся на две группы:
1) соленеобразующие (безразличные или индифферентные);
2) солеобразующие.
Соленеобразующие – оксиды, которые при химических реакциях не образуют солей и образованы неметаллическими элементами в низших степенях окисления, например: N2O – оксид азота (I), NO – оксид азота (II), SO – оксид серы (II), SiO – оксид кремния (II).
Солеобразующие – оксиды, которые при химических реакциях образуют соли. Они подразделяются на три группы:
1) основные оксиды;
2) кислотные оксиды;
3) амфотерные оксиды.
Номенклатура (название) оксидов: Название оксида образуется из слова оксид и русского названия элемента в родительном падеже. Если элемент имеет переменную степень окисления и образует несколько оксидов, то в их названии указывается степень окисления римской цифрой в скобках после названия. Например: FeO – оксид железа (II), N2O – оксид азота (I), MnO2 – оксид марганца (IV) и т.д.
Основные оксиды
Основными оксидами называют оксиды, которым соответствуют основания –  . Основные оксиды образуются только металлическими элементами в низших степенях окисления (+1, +2), например:
. Основные оксиды образуются только металлическими элементами в низших степенях окисления (+1, +2), например:  ;
;  ;
; 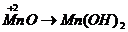 ;
; 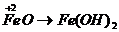 ;
;  ;
;  ;
;  и т.д. Основные оксиды могут быть получены несколькими способами.
и т.д. Основные оксиды могут быть получены несколькими способами.
1 способ: Окисление простого вещества – металла кислородом
2Fe + O2  2FeO,
2FeO,
2Ca + O2 → 2CaO.
Этот способ неприемлим для щелочных металлов (за исключением лития), которые при окислении образуют пероксиды или супероксиды, например:
2Na + O2 → Na2O2,
2К + 2О2 → К2О4.
Оксид натрия можно получить восстановлением Na2O2 металлическим натрием:
Na2O2 +2Na → 2Na2O.
2 способ: Термическое разложение оснований (кроме оснований щелочных металлов), например: Mg(OH)2  MgO + H2O.
MgO + H2O.
3 способ: Разложение некоторых солей, например, карбонатов (кроме карбонатов щелочных металлов), например:
CaCO3  CaO + CO2.
CaO + CO2.
4 способ: Окисление (обжиг) сульфидов металлов:
2MnS + 3O2 → 2MnO + 2SO2.
Не нашли, что искали? Воспользуйтесь поиском: