
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Номенклатура (название) кислот
Названия кислородосодержащих кислот производятся от названия элемента, образующего кислоту с прибавлением окончаний - ная, - вая, если степень окисления неметалла соответствует номеру группы периодической системы, где расположен неметалл. При понижении степени окисления суффикс меняется на – истая (таблица 5).
 – азот ная кислота;
– азот ная кислота; 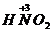 – азот истая кислота;
– азот истая кислота;
 – сер ная кислота;
– сер ная кислота;  – серн истая кислота.
– серн истая кислота.
Если элемент в одной и той же степени окисления образует несколько кислородосодержащих кислот, то к названию кислоты с меньшим содержанием водородных атомов добавляется приставка «мета», при наибольшем числе – приставка «орто».
 – мета фосфорная кислота;
– мета фосфорная кислота; 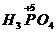 – орто фосфорная кислота;
– орто фосфорная кислота;
 – мета кремниевая кислота;
– мета кремниевая кислота;  – орто кремниевая кислота.
– орто кремниевая кислота.
Названия бескислородных кислот производятся от названия неметалла с окончанием - о и прибавлением слова водородная:
HF – фтор о водородная; HCl – хлор о водородная; H2S – сер о водородная.
Таблица 5 – Формулы и названия наиболее употребляемых кислот и их кислотных остатков
| Кислота | Кислотный остаток | ||
| Формула | Название | Формула | Название |
| H2SO4 | Серная | HSO 
| Гидросульфат |
SO 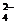
| Сульфат | ||
| HNO3 | Азотная | NO 
| Нитрат |
| HCl | Хлороводородная (соляная) | Cl- | Хлорид |
| HBr | Бромоводородная | Br 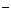
| Бромид |
| HJ | Йодоводородная | J 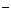
| Йодид |
| HClO3 | Хлорноватая | ClO 
| Хлорат |
| HClO4 | Хлорная | ClO 
| Перхлорат |
| HMnO4 | Марганцевая | MnO 
| Перманганат |
| HF | Фтороводородная (плавиковая) | F 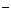
| Фторид |
| H2S | Сероводородная | HS 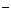
| Гидросульфид |
S 
| Сульфид | ||
| H2SO3 | Сернистая | HSO 
| Гидросульфит |
SO 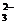
| Сульфит | ||
| HNO2 | Азотистая | NO 
| Нитрит |
| HPO3 | Метафосфорная | PO 
| Метафосфат |
| H3PO4 | Ортофосфорная | H2PO 
| Дигидроортофосфат |
HPO 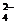
| Гидроортофосфат | ||
PO 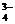
| Ортофосфат | ||
| H2CO3 | Угольная | HCO 
| Гидрокарбонат |
CO 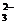
| Карбонат | ||
| H2SiO3 | Метакремниевая | HSiO 
| Гидрометасиликат |
SiO 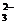
| Метасиликат | ||
| H4SiO4 | Ортокремниевая | SiO 
| Ортосиликат |
| H2CrO4 | Хромовая | HCrO 
| Гидрохромат |
CrO 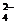
| Хромат | ||
| H2Cr2O7 | Двухромовая | HCr2O 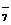
| Гидродихромат |
Cr2O 
| Дихромат | ||
| CH3COOH | Этановая (уксусная) | CH3COO 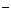
| Ацетат |
| H3BO3 | Борная | BO 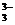
| Борат |
| HCN | Циановодородная (синильная) | CN 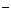
| Цианид |
| HCOOH | Метановая (муравьиная) | HCOO 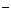
| Формиат |
Получение кислот
Бескислородные кислоты могут быть получены:
1 способ: Взаимодействие неметаллов с водородом, например:
H2 + Cl2 → 2HCl,
H2 + S → H2S.
2 способ: Взаимодействие растворов солей с более сильными кислотами, например:
FeS + 2HCl → FeCl2 + H2S,
2NaCl + H2SO4  2HCl↑ + Na2SO4.
2HCl↑ + Na2SO4.
3 способ: Взаимодействием некоторых простых веществ с водой, например:
Cl2 + H2O → HCl + HClO.
Кислородные кислоты можно получить:
1 способ: Взаимодействием растворимых кислотных оксидов с водой, например:
P2O5 + 3H2O → 2H3PO4,
SO3 + H2O → H2SO4.
Нужно помнить: при растворении некоторых оксидов с водой может образоваться несколько кислот, например:
| P2O5 + 3H2O → 2H3PO4, | 2ClO2 + H2O → HClO2 + HClO3, |
| P2O5 + H2O → 2HPO3, | 2NO2 + H2O → HNO3 + HNO2, |
| P2O5 + 2H2O → H4P2O7. | N2O4 + H2O → HNO3 + HNO2. |
2 способ: Реакцией обмена между раствором соли и более сильной кислотой, например:
Na2SiO3 + H2SO4 → H2SiO3↓ + Na2SO4.
При рассмотрении этого способа получения кислот нужно помнить о ряде активности кислот:



 HCl, HBr, HI
HCl, HBr, HI

 H2SO4 H2SO3, H2CO3, HF, HNO2, H2S,
H2SO4 H2SO3, H2CO3, HF, HNO2, H2S,
HNO3, HClO4 H3PO4, CH3COOH и др.
Реакции протекают преимущественно в прямом направлении.
3 способ: Взаимодействием некоторых простых веществ с водой, например:
Cl2 + H2O → HClO + HCl.
4 способ: Гидролизом растворимых бинарных соединений, например:
Cl3N + 3HOH → 3HClO + NH3.








 Химические свойства кислот
Химические свойства кислот
1) Водные растворы кислот изменяют окраску индикаторов (таблица 6).
Таблица 6 – Окраска индикаторов в растворах кислот
| Индикатор | Цвет индикатора | Цвет индикатора в растворе кислоты(рН < 7) |
| лакмус | фиолетовый | красный |
| фенолфталеин | бесцветный | бесцветный |
| метилоранж | оранжевый | розовый (красный) |
2) При растворении в воде кислоты диссоциируют.
Сильные одноосновные кислоты диссоциируют в водных растворах полностью (на 100%) на ионы водорода и кислотный остаток, например:
HCl → H+ + Cl 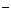 ,
,
HClO4 → H+ + ClO  .
.
Слабые кислоты (HF, HNO2, CH3COOH, H2CO3, H2S, H3PO4 и др.) в водных растворах диссоциируют незначительно. Процесс диссоциации обратим. При этом устанавливается химическое равновесие между молекулами слабой кислоты и ионами, на которые идет диссоциация, например:
HCN ↔ H+ +CN 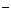 .
.
Многоосновные кислоты в водных растворах диссоциируют по ступеням с постепенным отщеплением катионов водорода Н+.
Таким образом, сколько катионов водорода Н+ содержится в молекуле кислоты, столько будет ступеней диссоциации у этой кислоты.
Нужно помнить, что многоосновные сильные кислоты по первой ступени диссоциируют необратимо, а слабые кислоты по всем ступеням диссоциируют обратимо, например:
1 ступень: H2SO4 → H+ + HSO  ,
,
2 ступень: HSO  ↔ H+ + SO
↔ H+ + SO 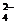 .
.
1 ступень: H2CO3 ↔ H+ + HCO  ,
,
2 ступень: HCO  ↔ H+ + CO
↔ H+ + CO 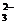 .
.
1 ступень: H2S ↔ H+ + HS 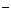 ,
,
2 ступень: HS 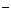 ↔ H+ + S2-.
↔ H+ + S2-.
1 ступень: H3РO4 ↔ H+ + H2PO  ,
,
2 ступень: H2PO  ↔ H+ + HPO
↔ H+ + HPO 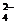 ,
,
3 ступень: HPO 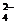 ↔ H+ + PO
↔ H+ + PO 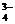 .
.
Ступенчатой диссоциацией многоосновных кислот объясняется образование кислых солей.
3) Взаимодействие с активными металлами разбавленных HCl, H2SO4 и некоторых других кислот (с образованием соли и выделением газообразного водорода), например:
Fe + 2HCl → FeCl2 + H2↑,
Zn + H2SO4 (разб.) → ZnSO4 + H2↑,
2Mg + CH3COOH → Mg(CH3COO)2 + H2↑.

 Малоактивные металлы в этих реакциях не участвуют, например:
Малоактивные металлы в этих реакциях не участвуют, например:
 Ag + HCl
Ag + HCl  .
.
4) Взаимодействие металлов и неметаллов с концентрированной H2SO4 и разбавленной HNO3.
а) Концентрированная H2SO4 взаимодействует как с активными, так с малоактивными металлами и образуются различные продукты восстановления, например:
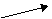 ZnSO4 + H2O + SO2 ↑,
ZnSO4 + H2O + SO2 ↑,
 Zn + H2SO4 (конц.) ZnSO4 + H2O + S,
Zn + H2SO4 (конц.) ZnSO4 + H2O + S,
 ZnSO4 + H2O + H2S ↑.
ZnSO4 + H2O + H2S ↑.
Чем активнее металл, тем больше будет выделяться H2S ↑.
б) При взаимодействии с малоактивными металлами, реакция идёт в одном направлении, например:
Сu + H2SO4 (конц.) → CuSO4 + H2O + SO2 ↑.
в) При взаимодействии разбавленной HNO3 реакция протекает в четырех направлениях, в каждом из направлений образуется соль активного металла, вода и различные продукты восстановления иона  (аммиак или соль аммония, либо оксид азота (І) и др.), например:
(аммиак или соль аммония, либо оксид азота (І) и др.), например:
 Zn(NO3)2 + H2O + NH3,
Zn(NO3)2 + H2O + NH3,
 Zn(NO3)2 + H2O + NH4NO3,
Zn(NO3)2 + H2O + NH4NO3,

 Zn + HNO3 (разбав.) Zn(NO3)2 + H2O + N2,
Zn + HNO3 (разбав.) Zn(NO3)2 + H2O + N2,
Zn(NO3)2 + H2O + N2O.
Какой продукт восстановления иона  образуется, зависит от активности металла, площади его соприкосновения с кислотой и концентрации разбавленной HNO3.
образуется, зависит от активности металла, площади его соприкосновения с кислотой и концентрации разбавленной HNO3.
г) При взаимодействии разбавленной HNO3 с малоактивными металлами, реакция идёт только в одном направлении, например:
Cu + HNO3 (разбав.) → Cu(NO3)2 + H2O + NO ↑.
д) Концентрированная H2SO4 и HNO3 кислоты взаимодействует с некоторыми неметаллами – активными восстановителями. При этих реакциях образуются оксиды неметаллов, оксиды серы или азота, например:
H2SO4 (конц.) + С → СO2 + SO2 + H2O,
HNO3 (конц.) + С → СO2 + NO2 + H2O.
5) Взаимодействие с основными и амфотерными оксидами, например:
MgO + H2SO4 → MgSO4 + H2O,
CaO + 2HCl → CaCl2 + H2O,
ZnO + 2HNO3 → Zn(NO3)2 + H2O,
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
6) Взаимодействие с основными и амфотерными гидроксидами, например:
KOH + HCl → KCl + H2O,
2NaOH + H2SO4 → Na2SO4 + 2H2O,
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O,
Cr(OH)3 + 3HCl → CrCl3 + 3H2O.
При взаимодействии с многокислотными основаниями и амфотерными гидроксидами реакции протекают по ступеням с образованием основных и средних солей, например:
1 ступень: Fe(OH)3 + HCl → Fe(OH)2Cl + H2O,
2 ступень: Fe(OH)3 + 2HCl → Fe(OH)Cl2 + 2H2O,
3 ступень: Fe(OH)3 + 3HCl → FeCl3 + 3H2O.
При взаимодействии многоосновных кислот с основаниями реакции протекают по ступеням с образованием кислых и средних солей, например:
1 ступень: Н3РО4 + КОН → КН2РО4 + H2O,
2 ступень: Н3РО4 + 2КОН → К2НРО4 + 2H2O,
3 ступень: Н3РО4 + 3КОН → К3РО4 + 3H2O.
7) Взаимодействие с некоторыми нормальными (или средними) солями с образованием новой соли и новой кислоты. Эти реакции возможны в том, случае, если образуется труднорастворимое или газообразное соединение, более слабая кислота, чем исходная, например:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl,
AgNO3 + HCl → AgCl↓ + HNO3,
K2SiO3 + 2HCl → H2SiO3↓ + 2KCl,
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O.
8) Термическое разложение кислородных кислот, например:
H2SiO3  H2O + SiO2,
H2O + SiO2,
H2CO3  H2O + CO2↑,
H2O + CO2↑,
4HNO3  4NO2 + 2H2O + O2,
4NO2 + 2H2O + O2,
H2SO4  H2O + SO3.
H2O + SO3.
> 98,3%
9) Диспропорционирование некоторых кислот в низких степенях окисления атома, образующего кислоту, например:
 ,
,
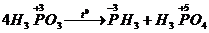 .
.
Не нашли, что искали? Воспользуйтесь поиском: