
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химические свойства амфотерных гидроксидов
Амфотерные гидроксиды взаимодействуют:
1) с кислотами (в этом случае они проявляют свойства труднорастворимых в воде оснований), например:
Al(OH)3 + 3HCl → AlCl3 + 3H2O,
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O,
Sn(OH)2 + H2SO4 → SnSO4 + 2H2O,
Pb(OH)2 + 2HNO3 → Pb(NO3)2 + 2H2O.
Реакции могут протекать с образованием основных солей, например:
Al(OH)3 + HCl → Al(OH)2Cl + H2O,
Al(OH)3 + 2HCl → Al(OH)Cl2 + 2H2O.
2) с основаниями (в этом случае они проявляют свойства кислот)
а) сплавление амфотерных гидроксидов с твердыми щелочами, например:
Al(OH)3 + NaOH  NaAlO2 + 2H2O↑,
NaAlO2 + 2H2O↑,
метаалюминат натрия
Al(OH)3 + 3NaOH  Na3AlO3 + 3H2O↑,
Na3AlO3 + 3H2O↑,
ортоалюминат натрия
Zn(OH)2 + 2NaOH  Na2ZnO2 + 2H2O↑;
Na2ZnO2 + 2H2O↑;
цинкат натрия
б) взаимодействие амфотерных гидроксидов с избытком растворов щелочей (образуются гидроксокомплексные соединения), например:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4],
тетрагидроксоцинкат натрия
Sn(OH)2 + 2NaOH → Na2[Sn(OH)4],
тетрагидроксостаннат (ΙΙ) натрия
Pb(OH)2 + 2NaOH → Na2[Pb(OH)4];
тетрагидроксоплюмбат (ΙΙ) натрия
в зависимости от концентрации растворов щелочи и соотношения реагентов могут образоваться гидрокомплексы различного состава, например:
Al(OH)3 + NaOH → Na[Al(OH)4],
тетрагидроксоалюминат натрия
Al(OH)3 + 3NaOH → Na3[Al(OH)6],
гексагидроксоалюминат натрия
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6].
гексагидроксохромат (ΙΙΙ) натрия
3) амфотерные гидроксиды распадаются при нагревании, например:
2Al(OH)3  Al2O3 + 3H2O.
Al2O3 + 3H2O.
Соли
Соли рассматривают, как продукты полного или частичного замещения водорода в кислотах на ион металла; или полного или частичного замещения гидроксид – ионов в основаниях или амфотерных гидроксидах на кислотные остатки. При диссоциации солей образуются катионы металлов или катионы сложного состава и анионы кислотных остатков или анионы сложного состава. В зависимости от полноты замещения ионов  кислоты или
кислоты или 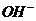 основания соли делятся на средние (или нормальные), кислые и основные. Рассмотрим состав каждой группы солей.
основания соли делятся на средние (или нормальные), кислые и основные. Рассмотрим состав каждой группы солей.
Не нашли, что искали? Воспользуйтесь поиском: