
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Б) Осаждение белков органическими растворителями
Этот способ широко используется в промышленности при производстве ферментных препаратов. При этом подбирается определенная концентрация осадителя, обеспечивающая выделение нужной белковой фракции. Для лучшего сохранения нативной структуры исследуемых белков все операции проводят при низкой температуре(+4 0С).
в) Высаливание белка. Нативная структура белков хорошо сохраняется при их осаждении сульфатом аммония (используют также соли щелочных и щелочноземельных металлов).
г) О саждение в изоэлектрической точке.
Избирательное осаждение белков можно провести путем изменения рН белкового раствора. При таком способе осаждения обычно сохраняется нативная структура белков, как в осадке, так и в надосадочной жидкости.
д) О саждение путем тепловой коагуляции
Осаждение белков можно проводить, варьируя тепловую обработку белкового экстракта. При этом, в первую очередь, выпадают в осадок более лабильные белки, а термостабильные белки остаются в растворе.
Пример: отделить  - амилазу от
- амилазу от 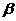 - амилазы можно путем нагревания солодовой вытяжки до 78 0С. При такой температуре
- амилазы можно путем нагревания солодовой вытяжки до 78 0С. При такой температуре 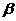 - амилаза инактивируется, а
- амилаза инактивируется, а  - амилаза сохраняет свою активность.
- амилаза сохраняет свою активность.
4 этап – о чистка белков. Если в дальнейшем необходимо получить белковый препарат более высокой степени чистоты, то применяют методы фракционирования, основанные на различных физико-химических свойствах индивидуальных белков.
а) Метод гель-фильтрации (метод молекулярных сит).
Этот метод был разработан в 1959 году. С его помощью проводят разделение веществ по молекулярной массе. В качестве геля применяют препараты сефадексов.
Через колону, заполненную набухшим сефадексом, пропускают исследуемый белковый раствор.
Белки, молекулы которых по своим размерам превосходят размеры ячеек в гранулах сефадекса, не могут проникнуть внутрь гранул и свободно проходят между частицами геля. Белки небольшой молекулярной массы частично проникают в гранулы сефадекса и распределяются в большем объеме и движутся по колонке с меньшей скоростью. Поэтому высокомолекулярные белки выходят из колонки раньше низкомолекулярных.
б) Электрофоретическое разделение белков.
Электрофорез – физический процесс разделения белков в электрическом поле постоянного тока.
Белковые молекулы, как амфотерные соединения, в буферных растворах несут заряды разные по величине и знаку. В электрическом поле постоянного тока белки движутся к аноду или катоду в зависимости от знака своего заряда. Скорость такого движения определяется величиной заряда.
Варианты электрофоретического разделения белков классифицируются в зависимости от типа электрической системы, типа носителя, конструкции аппаратуры и способа обнаружения разделяемых белковых фракций.
в) Изоэлектрическое фокусирование белков.
Принцип этого методы основан на разделении белков, имеющих разные изоэлектрические точки. Метод был разработан в Швеции в 60-х годах.
Изоэлектрическое фокусирование белков осуществляется в процессе их электрофоретического разделения на колонке, по высоте которой создается градиент рН.
Белок движется под воздействием электрического поля, пока не достигнет той области колонки, где рН соответствует изоэлектрической точке данного белка. Суммарный электрический заряд белка становится равным нулю, белок теряется в этой области подвижность и концентрируется в виде узкой зоны.
Молекулы разных белков фокусируются в разных частях колонки узкими зонами, при рН, соответствующих их изоэлектрическим точкам.
Не нашли, что искали? Воспользуйтесь поиском: