
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Метод кількісного обліку мікроорганізмів на твердих середовищах
Метод Коха – найбільш розповсюджений спосіб кількісного обліку м/о. Сутність методу полягає в посіві визначеного об’єму досліджуваної суспензії м/о на тверде середовище в чашки Петрі і наступному підрахунку числа колоній, що виросли. При цьому приймають, що кожна колонія утворюється розмноженням однієї клітини.
Цей метод дозволяє вести облік тільки життєздатних м/о. В аналізі беруть стерильно 1 мл суспензії і поміщають у 9 мл стерильної водопровідної води чи фізіологічного розчину, потім виконують низку послідовних розведень (рис. 9.1).

Рис. 9.1 – Схема готування розведення і посіву суспензії мікроорганізмів
Ступінь розведення перед посівом визначається передбачуваною кількістю м/о в зразку. Ґрунт є середовищем заселення великого числа різноманітних м/о. У 1 г ґрунту міститься від 1 до 10 млрд. кліток м/о.
У лабораторній практиці мікробіології немає універсального живильного середовища, на якому розвивалися б усі ґрунтові м/о, тому результати загальної чисельності м/о за методом висіву навіть на найбільш універсальні живильні середовища виходять заниженими.
Підрахунок чисельності кліток мікроорганізмів у рахункових камерах
Метод кількісного обліку м/о за допомогою рахункових камер має обмежене застосування, пов'язане з тим, що в цьому випадку виконується облік усіх кліток м/о без їх диференціації на живі та мертві клітини. Крім того, рахункові камери можуть бути використані лише для підрахунку щодо відносно великих об'єктів – кліток водоростей, дріжджів, спор, грибів, що можна дослідити методом мікроскопії з об'єктивами 8х-40х.
У випадку рухливості клітин препарат незначно підігрівають (чи додають краплю 0,1%-ного розчину агар-агару). Фіксація і фарбування препаратів призводить до деяких змін розмірів мікробних кліток.
Рахункова камера Горяєва являє собою товсте предметне скло з нанесеними на ньому поперечними прорізами, що утворять три поперечно розташовані плоскі площадки (рис. 9.2). Середня площадка подовжнім прорізом розділена навпіл, причому на кожній половині нанесена квадратна сітка. Дві бічні площадки розташовано на 0,1 мм вище за середню. Ці площадки слугують для притирання покривного скла. Сітка розділена на визначене число згрупованих великих і маленьких квадратів.
Постійною величиною у всіх сітках є маленький квадрат, сторона якого дорівнює 1/20 мм, площа його 1/400 мм2, а об’єм при висоті камери 1/10 мм – 1/4000 мм3 чи 1/4000000 мл. Так називаний великий квадрат складається з 16 малих квадратиків.
Камера Горяєва має площу 9 мм2, об’єм камери – 9 мм3 і розбита на 225 великих квадратів (15 рядів по 15 великих квадратів у кожнім ряду).
Підрахунок кліток у камері починають через 3-5 хвилин після заповнення її, коли клітини осіли й розташувалися в одній площині. Підрахунок кліток ведуть звичайно в 10 великих або в 20 малих квадратах, переміщаючи її за діагоналлю. З вихідної суспензії варто приготувати 3-4 кратні розведення.


В
Рис. 9.2 – Рахункова камера Горяєва:
А – вигляд зверху; Б – вигляд збоку; В – вигляд камери Горяєва з малим збільшенням мікроскопа
Порядок виконання роботи
1. Виконати посів за методом Коха суспензії зі зразка ґрунту, що розведений в 1000, 10000 раз на тверде вівсяне живильне середовище, МПА і середовище Гаузе. Результати інокуляції й підрахунок м/о зробити на наступному занятті.
Наважку підготовленого ґрунту (1 г) поміщають у чисту ступку з невеликою кількістю стерильної води і розтирають гумовою маточкою чи пальцем у гумовій рукавичці приблизно 5 хв.
Підготовлену суспензію переносять у колбу з 100 мл стерильної водопровідної води. Готують розведення ґрунтової суспензії, для чого 1 мл суспензії переносять послідовно в низку пробірок з 9 мл стерильної водопровідної води.
На поверхню твердого й підсушеного середовища наносять краплю ґрунтової суспензії визначеного розведення й за допомогою стерильного скляного шпателя розподіляють по всьому агару. Якщо висів виконують, починаючи з великих розведень, то використовують нову стерильну піпетку і новий шпатель для кожного розведення.
Засіяні чашки Петрі перевертають нагору дном і поміщають у термостат із визначеною температурою, яка сприятлива для розвитку м/о, що враховуються.
Підрахунок колоній, що виросли, виконують через визначений час після посіву (3-5 доби). На МПА звичайно на 2-3 добу інкубації враховують спорові й безспорові форми бактерій. На середовищі Гаузе на 5-7 добу враховують колонії актиноміцетів, на сусло-агарі на 5-7 добу – колонії грибів і дріжджів.
Колонії, як правило, рахують, не відкриваючи чашки Петрі, у прохідному світлі. Для зручності дно чашки поділяють на сектори, підраховують кількість колоній у кожнім секторі, кожну відлічену колонію позначають крапкою (маркером) із нижньої сторони чашки Петрі та результати підсумовують. Для підрахунку колоній зручно користатися спеціальним приладом із лічильником.
Точність методу залежить від числа підрахованих колоній: кращим розведенням вважають те, у висіві якого на твердому живильному середовищі виростає від 50 до 150 колоній.
Підрахувавши кількість колоній на всіх паралельних чашках, обчислюють їх середнє число на одній чашці і потім виконують перерахування для визначення вмісту м/о в 1 г ґрунти за формулою
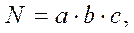 (9.1)
(9.1)
де N – кількість кліток у 1 г ґрунту; a – середня кількість колоній на чашці; b – розведення, із якого зроблений посів; c – кількість крапель у 1 мл суспензії.
2. Приготувати препарат із добової культури дріжджів роду Saccharomyces і підрахувати кількість клітин у вихідній суспензії.
Мікробіологічною петлею краплю, суспензії дріжджів наносять у центр рахункової камери. Рахункову камеру покривають покривним склом, ретельно притираючи його з країв до утворення ньютонівських кілець (кольорових смуг).
Підрахунок клітин дріжджів робити (зі збільшенням мікроскопа: окуляр 10-15х, об'єктив 20-40х) у 20 малих квадратах, у 3-4 пробах досліджуваної суспензії. Загальне число підрахованих кліток мікроорганізмів повинне бути не менш 600, тому беруть 3-4 проби з досліджуваної суспензії для монтажу камери.
Потім розраховують середнє число мікробних кліток в одному малому квадраті і роблять перерахування на вміст у 1 мл вихідної суспензії за формулою
 (9. 2)
(9. 2)
де N – число кліток у 1 мл суспензії; а – середнє число кліток у малому квадраті сітки; h – глибина камери в мм; s – площа малого квадрата сітки в мм 2; n – розведення вихідної суспензії; 1000 – коефіцієнт перерахування мм3 у мл.
Результати роботи протоколюють.
Петлі, голки обпалюють у полум'ї пальника. Посуд дезінфікують.
3. Зробити посіви мікроорганізмів для наступного заняття.
Лабораторна робота № 10
Тема: Вивчення здібності мікроорганізмів до ферментоутворення
Мета: Визначити можливісті мікроорганізмів до синтезу позаклітинних ферментів.
Матеріали та устаткування: Мікроскоп МБР, предметні й покривні скельця, імерсійна олія, бактеріологічна петля, стерильні піпетки, чисті культури м/о, що виросли на скошеному середовищі, 3%-ний розчин пероксиду водню, стерильне молоко, стовпчики з МПЖ, спиртівка (брикети сухого пального), 1%-ний спиртовий розчин a-нафтолу і свіжоприготовлений 1%-ний водяний розчин диметил-п-фенілендіамину, стерильні чашки Петрі.
Мікроорганізми здатні використовувати в якості поживних субстратів найрізноманітніші високомолекулярні сполуки. Але макромолекули не можуть проникати через мембрану клітини. Вони розщеплюються під дією екзоферментів, що належать до класу гідролаз. Більшість з них каталізує гідроліз полімерів до розчинних продуктів, частіше дімерів або мономерів, які поступають в клітину за допомогою специфічних транспортних механізмів. Утворення екзоферментів широко розповсюджено серед представників різних груп мікроорганізмів.
Амілолітична активність.
Крохмаль підлягає гідролітичному розщепленню під дією амілаз, активними продуцентами яких є різні види бацил, псевдомонад, стрептоміцетів, міцеліальних грибів, тощо.
Для виявлення амілолітичної активності використовують тверде середовище до складу якого входить крохмаль як єдине джерело вуглецю. Гідроліз крохмалю виявляють після оброблення агарової пластинки розчином Люголя. Середовище, що містить крохмаль, зафарбовується в синій колір, а зона гідролізу залишається безфарбною або набуває червоно-бурого забарвлення, якщо крохмаль гідролізувався до декстринів. Зону гідролізу крохмалю вимірюють в мм від краю колонії до межі світлої зони. Чим більший діаметр світлої зони, тим вища амілолітична активність.
Протеолітична активність.
Протеолітичні ферменти (протеази) каталізують розщеплення білків на фрагменти: полі та олігопептіди. Протеази виділяються різними видами бацил, актиноміцетів, міцеліальних грибів, тощо. Активність позаклітинних протеаз визначають, використовуючи в якості субстрату желатин, казеїн та інші білки.
Для спостереження за протеолізом желатину, культуру висівають на м’ясо-пептонний желатин. Для виявлення протеолізу казеїну використовують молочний агар.
Не нашли, что искали? Воспользуйтесь поиском: