
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Термодинамика – как аксиоматическая система.
«Термодинамика – наука о силах, связанных с теплом».
У. Томсон
Формально термодинамику определяют как науку о наиболее общих свойствах макроскопических физических систем, находящихся в состоянии теплового равновесия. Физические тела и их модели называют в термодинамике термодинамическими системами.
Суть термодинамического подхода в том, что термодинамическая система состоит из громадного числа элементов (атомов, молекул, ионов), но в термодинамике рассматривают только макроскопические параметры, т.е. системные, характеризующие свойства системы как целостного объекта, которые определяют феноменологически. Совокупность параметров, позволяющих полностью описать поведение системы, определяет состояние системы. Входящие в неё параметры называют параметрами состояния.
Термодинамика сформировалась в процессе решения проблем нагревания и охлаждения и проблем использования тепловых двигателей. Часть параметров, характеризующих термодинамическую систему, взята из механики (масса, давление, количество вещества, плотность, объём), часть представляет собой специфические параметры термодинамики (количество теплоты, температура, теплоёмкость, энтропия).
Рассмотрим более подробно величины, используемые в термодинамике.
1.  ‑ объём идеального газа. (Идеальный газ – фундаментальная модель, которая описывается уравнением Клайперона-Менделеева (см. выше) и калорическим уравнением состояния идеального газа:
‑ объём идеального газа. (Идеальный газ – фундаментальная модель, которая описывается уравнением Клайперона-Менделеева (см. выше) и калорическим уравнением состояния идеального газа:  (см. ниже). Объём идеального газа равен объёму сосуда, в котором он находится, т.е. геометрическому объёму без учёта объёма молекул, составляющих газ.
(см. ниже). Объём идеального газа равен объёму сосуда, в котором он находится, т.е. геометрическому объёму без учёта объёма молекул, составляющих газ.
2.  ‑ масса газа,
‑ масса газа, 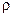 ‑ плотность газа, равна отношению массы газа к его объёму.
‑ плотность газа, равна отношению массы газа к его объёму.
3.  ‑ относительная молекулярная (атомная) масса
‑ относительная молекулярная (атомная) масса  , где
, где  ‑ масса молекулы (атома),
‑ масса молекулы (атома),  ‑ единица атомной массы, равная
‑ единица атомной массы, равная 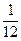 части массы атома изотопа углерода
части массы атома изотопа углерода  ; 1 атомная единица массы (а.е.м.) равна
; 1 атомная единица массы (а.е.м.) равна 
 . В выбранной шкале относительная атомная масса углерода
. В выбранной шкале относительная атомная масса углерода  Количество вещества в СИ выражают в молях. Моль является основной единицей СИ. В 1 моле содержится столько атомов (молекул, ионов) сколько атомов содержится в 0,012 кг
Количество вещества в СИ выражают в молях. Моль является основной единицей СИ. В 1 моле содержится столько атомов (молекул, ионов) сколько атомов содержится в 0,012 кг  . Молярной массой (М) называют массу одного моля вещества, численно равную
. Молярной массой (М) называют массу одного моля вещества, численно равную  . Таким образом,
. Таким образом,  есть число молей вещества.
есть число молей вещества.
4.  ‑ давление газа – равно отношению нормальной компоненты контактной силы
‑ давление газа – равно отношению нормальной компоненты контактной силы  , действующей на площадку, к величине этой площадки
, действующей на площадку, к величине этой площадки 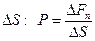 ; давление не зависит от ориентации площадки. Размерность давления
; давление не зависит от ориентации площадки. Размерность давления 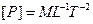 . В СИ единица давления – паскаль
. В СИ единица давления – паскаль  .
.
5. Температура – мера теплового равновесия. Температура является основной величиной в системе СИ, и единица измерения температуры – кельвин – задаётся как эталон. Кельвин – единица температуры, взятой по абсолютной термодинамической шкале, которая создана на базе второго закона термодинамики и не зависит от свойств какого-либо вещества; с другой стороны, её использование связано с определёнными неудобствами и поэтому используют так называемые практические шкалы. Рассмотрим вопрос подробней.
Итак, температуру определяют по температурному изменению физического свойства какого-либо вещества, удобного для измерений (давлению газа, электрическому сопротивлению, тепловому расширению тел,...). Шкала определяет правила нахождения температуры. При её построении берут две фиксированные точки (для одной значение физического параметра равно  , для другой
, для другой  ) и каждой точке приписывают произвольное значение температуры
) и каждой точке приписывают произвольное значение температуры  и
и  .
.
Разность температур  называется основным температурным интервалом. Считая, что связь между свойством
называется основным температурным интервалом. Считая, что связь между свойством  и температурой
и температурой  линейная, и полагая для удобства
линейная, и полагая для удобства  (поскольку выбор произвольный) получают правило нахождения температуры
(поскольку выбор произвольный) получают правило нахождения температуры
 .
.
Поскольку число веществ, физические свойства которых могут служить для построения температурных шкал, велико, то и температурных шкал можно построить великое количество, и использовать те из них, которые для измерения в конкретных условиях самые удобные. С другой стороны, поскольку свойства веществ, использующиеся при построении шкал различны и независимы, то возникают проблемы пересчёта температур от одной шкалы к другой. А это можно сделать только при проведении экспериментальных работ. Именно абсолютная термодинамическая шкала температур свободна от зависимости термометрических свойств веществ, поскольку, как уже было сказано выше, основана на втором законе термодинамики. При этом абсолютная температура  , которая определяется по этой шкале, входит во все формулы термодинамики. Как и для любой шкалы, при построении термодинамической выбирают две точки, приписывают одной
, которая определяется по этой шкале, входит во все формулы термодинамики. Как и для любой шкалы, при построении термодинамической выбирают две точки, приписывают одной  , а другой
, а другой  . Такую температуру имеет тающий лёд при нормальном давлении. Единицу температуры этой шкалы (шкалы Кельвина) и назвали кельвин. Для практических целей измерение термодинамической температуры (по шкале Кельвина) с высокой точностью очень трудно, поэтому используют, как уже ранее сказано, практические шкалы. Широко используемой практической шкалой является шкала Цельсия, в которой температура тающего льда принимается за
. Такую температуру имеет тающий лёд при нормальном давлении. Единицу температуры этой шкалы (шкалы Кельвина) и назвали кельвин. Для практических целей измерение термодинамической температуры (по шкале Кельвина) с высокой точностью очень трудно, поэтому используют, как уже ранее сказано, практические шкалы. Широко используемой практической шкалой является шкала Цельсия, в которой температура тающего льда принимается за  , а температура кипящей воды за
, а температура кипящей воды за  , при этом единица температуры для стоградусной шкалы Цельсия совпадает с единицей температуры шкалы Кельвина. Это приводит к связи между температурами измеренными по шкале Цельсия и шкале Кельвина
, при этом единица температуры для стоградусной шкалы Цельсия совпадает с единицей температуры шкалы Кельвина. Это приводит к связи между температурами измеренными по шкале Цельсия и шкале Кельвина
 .
.
6. Количество теплоты. Объяснение тепловых явлений началось в начале 17 века, когда Галилей (1613 г.) ввёл «тепловое вещество – теплород», который был способен проникать во все тела и выходить из них, вызывая при этом нагревание или охлаждение тела. Таким образом, изменение нагретости тела связывали с изменением количества теплорода. В 1760 г. Блэк вводит строгое различие между количеством тепла ( ) и температурой. Появляется термин «теплоёмкость» и вводится единица количества теплоты – калория. Калория – количество теплоты, необходимое для нагревания 1 г воды на
) и температурой. Появляется термин «теплоёмкость» и вводится единица количества теплоты – калория. Калория – количество теплоты, необходимое для нагревания 1 г воды на  , а именно: повышает температуру воды от
, а именно: повышает температуру воды от  до
до  . Это количество носит название «20-ти градусной калории». Конкретизация температур, при которых измеряют теплоёмкость, обусловлена наличием температурной зависимости теплоёмкости от температуры. Однако зависимость эта невелика и в практических расчётах её можно не учитывать.
. Это количество носит название «20-ти градусной калории». Конкретизация температур, при которых измеряют теплоёмкость, обусловлена наличием температурной зависимости теплоёмкости от температуры. Однако зависимость эта невелика и в практических расчётах её можно не учитывать.
По сути, через определение калории вводится физическая величина «удельная теплоёмкость» ‑ количество теплоты, необходимое для нагревания единицы массы вещества на один градус.
 .
.
Для воды теплоёмкость  ; для других веществ её надо измерять.
; для других веществ её надо измерять.
В 19 веке многочисленные опыты показали несостоятельность теплорода, и постепенно теплород был вытеснен из науки, но тепловые величины и их функциональные связи остались, только приобрели другое физическое содержание. В экспериментах стали обнаруживать, что при получении тепла за счёт работы, и работы за счёт тепла используется определённое количество работы. Были проведены специальные опыты, которые определили количественно механический эквивалент тепла. Согласно ему, одна калория равна  ; джоуль – единица измеренной работы в СИ. Она и используется в качестве единицы измерения количества теплоты в системе СИ. Калория является внесистемной единицей. Количество теплоты определяют в приборах, которые носят название «калориметры». Конструкции их разнообразны, они позволяют измерять количество теплоты в диапазоне температур
; джоуль – единица измеренной работы в СИ. Она и используется в качестве единицы измерения количества теплоты в системе СИ. Калория является внесистемной единицей. Количество теплоты определяют в приборах, которые носят название «калориметры». Конструкции их разнообразны, они позволяют измерять количество теплоты в диапазоне температур  , и используют для измерения теплоты различные свойства и их функциональные связи. Так, в жидкостном калориметре, который состоит из сосуда с жидкостью (обычно водой), в котором находится исследовательская камера («калориметрическая бомба»), мешалка, нагреватель и термометр, используют связь
, и используют для измерения теплоты различные свойства и их функциональные связи. Так, в жидкостном калориметре, который состоит из сосуда с жидкостью (обычно водой), в котором находится исследовательская камера («калориметрическая бомба»), мешалка, нагреватель и термометр, используют связь  , где
, где  ‑ теплоёмкость калориметрической системы,
‑ теплоёмкость калориметрической системы,  ‑ изменение температуры, вызванное исследуемым процессом.
‑ изменение температуры, вызванное исследуемым процессом.
Таким образом, измерение теплоты сводится к измерению температуры. Количество теплоты, поглощённое телом, зависит не только от начального и конечного состояний, но и от способа, которым реализуется процесс перехода между ними. Соответственно от способа нагревания тела зависит и его теплоёмкость. Различают теплоёмкость при постоянном объёме ( ) и теплоёмкость при постоянном давлении (
) и теплоёмкость при постоянном давлении ( ). Для идеального газа разность молярных теплоёмкостей
). Для идеального газа разность молярных теплоёмкостей  .
.  ‑ универсальная газовая постоянная, равная
‑ универсальная газовая постоянная, равная  (молярная теплоёмкость – количество теплоты, необходимое для нагревания одного моля вещества на один градус).
(молярная теплоёмкость – количество теплоты, необходимое для нагревания одного моля вещества на один градус).
Если каждый параметр, характеризующий термодинамическую систему, имеет одинаковое значение во всех частях системы, то систему считают физически однородной. Если термодинамическую систему изолировать от внешней среды (т.е. исключить влияние среды на тело), то через определённый (как правило, длительный) промежуток времени независимо от начального состояния система станет однородной, причём численные значения параметров будут оставаться постоянными сколь угодно долгое время. Такое состояние называется равновесным. Равновесное состояние полностью характеризуется небольшим числом параметров, а именно установлено, что заданным значениям температуры, молярного объёма  соответствует единственное значение давления:
соответствует единственное значение давления:  . Эта формула носит название термического уравнения состояния системы. Конкретный вид зависимости устанавливают эмпирически. Точная зависимость установлена только для газов в разреженном состоянии. Это известный закон Клайперона-Менделеева
. Эта формула носит название термического уравнения состояния системы. Конкретный вид зависимости устанавливают эмпирически. Точная зависимость установлена только для газов в разреженном состоянии. Это известный закон Клайперона-Менделеева 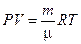 , известный ещё как объединённый газовый закон и являющийся обобщением газовых законов Бойля-Мариотта (
, известный ещё как объединённый газовый закон и являющийся обобщением газовых законов Бойля-Мариотта ( , Шарля
, Шарля  , Гей-Люссака
, Гей-Люссака  , открытых экспериментально.
, открытых экспериментально.
В формулах:  ‑ масса газа;
‑ масса газа;  ‑ его молярная масса;
‑ его молярная масса;  ‑ давление газа;
‑ давление газа;  ‑ объём газа;
‑ объём газа;  ‑ температура в
‑ температура в  ;
; 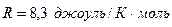 ‑ молярная газовая постоянная.
‑ молярная газовая постоянная.
Переход термодинамической системы из одного состояния в другое называют термодинамическим процессом. При переходе система проходит ряд состояний, которые не обязательно будут равновесными. Чтобы гарантировать равновесность промежуточных состояний, необходимо чтобы процесс протекал достаточно медленно. Такие процессы называют квазистатическим и. Если процесс равновесный, то он является обратимым, т.е. его можно совершить в обратном направлении без каких-либо изменений во внешней среде. Именно обратимые процессы можно полностью количественно описать.
Основными законами, имеющими ранг фундаментальных аксиом, управляющими термодинамическими процессами, являются начала термодинамики.
I начало:  .
.
 ‑ приращение внутренней энергии;
‑ приращение внутренней энергии;  ‑ количество теплоты, полученной (или отданной) системой;
‑ количество теплоты, полученной (или отданной) системой;  ‑ работа, совершаемая системой (или над системой).
‑ работа, совершаемая системой (или над системой).
Поскольку  и
и  могут быть как положительными, так и отрицательными, то по сути I начало термодинамики является законом сохранения энергии.
могут быть как положительными, так и отрицательными, то по сути I начало термодинамики является законом сохранения энергии.
Рассмотрим подробнее величины, входящие в закон. Если газ, находящийся в сосуде с закреплённым поршнем нагреть, то его температура увеличится. Как ранее было сказано, первым объяснением этого явления было наличие в газе теплорода, который способен проникать во все тела и выходить из них, изменяя при этом температуру. Многочисленные опыты показали несостоятельность теплорода, и тогда у учёных появилось мнение, что за тепловые свойства ответственны атомы и молекулы, из которых и формируются макроскопические тела. Была создана молекулярно-кинетическая теория, согласно которой кинетическая энергия молекул газа пропорциональна его температуре. Кинетическая энергия молекул образуется за счёт хаотического движения молекул, однако молекулы в реальных телах (газах) взаимодействуют между собой, а значит, имеет место и потенциальная энергия молекул. Сумма кинетической энергии молекул и потенциальной энергии их взаимодействия составляют внутреннюю энергию тела.
Итак, в процессе нагревания увеличивается температура тела и следовательно имеет место увеличение его внутренней энергии, т.е. внутренняя энергия получает приращение  . Энергия, в том числе и внутренняя, является функцией состояния, а значит её приращение не зависит от условий нагревания, а определяется только разностью начального и конечного значений. В математической модели это означает, что малое приращение внутренней энергии можно описать полным дифференциалом, т.е.
. Энергия, в том числе и внутренняя, является функцией состояния, а значит её приращение не зависит от условий нагревания, а определяется только разностью начального и конечного значений. В математической модели это означает, что малое приращение внутренней энергии можно описать полным дифференциалом, т.е.

 .
.
Но если есть приращение энергии, то значит, есть и форма передачи энергии.
Форму передачи внутренней энергии телу без изменения объёма называют теплотой, а её количественную характеристику, меру передачи, называют количеством теплоты. Таким образом, теплота не является свойством тела, она – свойство процесса (нагревания) и как характеристика процесса зависит от вида процесса: т.е. её количественное значение для различных процессов неодинаково. В математической модели это означает, что количество теплоты не может быть выражено полным дифференциалом, и его обозначают  .
.
Если поршень сделать свободным и нагреть при этих условиях газ, находящийся в цилиндре, то, кроме нагревания газа, будет иметь место увеличение его объёма. При этом будет совершаться работа.
Таким образом, работа есть форма передачи энергии при изменении объёма термодинамической системы. Количественная характеристика, т.е. мера передачи работы, имеет название количество работы. Работа, как и теплота, тоже является характеристикой процесса и зависит от типа процесса. В математической модели её нельзя описать полным дифференциалом и её обозначают  .
.
Итак, существует внутренняя энергия, приращение которой как функции состояния термодинамической системы обозначают  , и две формы передачи энергии ‑ теплота, мера которой количество теплоты обозначается
, и две формы передачи энергии ‑ теплота, мера которой количество теплоты обозначается  и работа ‑
и работа ‑  .
.
Теплота и работа представляют собой эквивалентные формы передачи энергии. При превращении тепла в работу, каждая превратившаяся в работу единица количества теплоты (например, 1 килокалория) даёт 427 килограммометров работы.
С другой стороны, теплота и работа являются неравноценными формами передачи энергии. Их неравноценность обусловлена их качественным различием: теплота обусловлена совокупностью микрофизических процессов (соударение молекул, излучение квантов света и т.п.); работа есть макрофизическая форма передачи энергии. Как результат их неравноценности – работа может быть непосредственно совершена для пополнения запаса любого вида энергии[1] (потенциальной энергии сила тяжести, электрической, магнитной энергии и т.п.), теплота же непосредственно, без промежуточного преобразования в работу, может только пополнить внутреннюю энергию тела.
Рассмотрим конкретные формулы для работы газа при различных процессах.
Для любого процесса элементарная работа  , т.е. равна произведению давления газа на приращение объёма. Математическая модель
, т.е. равна произведению давления газа на приращение объёма. Математическая модель  . Полная работа вычисляется по формуле
. Полная работа вычисляется по формуле  , где
, где  ‑ начальный, а
‑ начальный, а  ‑ конечный объёмы газа.
‑ конечный объёмы газа.
1. Изохорический процесс:  . Работа
. Работа  .
.
2. Изобарический процесс:  .
.  .
.
3. Изотермический процесс:  .
.  , где
, где  ‑ начальное,
‑ начальное,
 ‑ конечное давление газа.
‑ конечное давление газа.
4. Процесс, при котором  называют адиабатическим. Уравнение адиабатического процесса
называют адиабатическим. Уравнение адиабатического процесса  , где
, где  ;
; 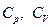 ‑ соответственно теплоёмкости газа при постоянном давлении и постоянном объёме. Работа при адиабатическом процессе
‑ соответственно теплоёмкости газа при постоянном давлении и постоянном объёме. Работа при адиабатическом процессе  , где
, где  и
и  соответственно начальная и коечная температуры.
соответственно начальная и коечная температуры.
II начало термодинамики определяет направленность процесса и имеет несколько формулировок. Так, Р. Клаузиус (1856 г.) даёт такую: невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более нагретым. Наиболее общую формулировку он предложил в 1876 г.: существует функция состояния системы – её энтропия  , приращение которой
, приращение которой  при обратимом сообщении системе количества теплоты
при обратимом сообщении системе количества теплоты  равно
равно  , а при необратимых (реальных) адиабатических процессах
, а при необратимых (реальных) адиабатических процессах  , т.е. энтропия возрастает, достигая максимального значения в состоянии равновесия.
, т.е. энтропия возрастает, достигая максимального значения в состоянии равновесия.
Поскольку начала являются аксиомами, то, используя их, можно получать новые величины и устанавливать новые законы. Так, можно получить уравнение 
 .
.
Это уравнение, определяющее зависимость молярной теплоёмкости при постоянном объёме от температуры и молярного объёма, называют калорическим уравнением состояния вещества.
Совместное использование термического и калорического уравнений состояния полностью описывает свойства термодинамической системы.
Большое значение для практического использования имеют циклические процессы.
Циклический процесс – термодинамический процесс, в котором термодинамическая система приходит в первоначальное состояние. Из-за этого приращение внутренней энергии  и количество теплоты, данное системе
и количество теплоты, данное системе  , полностью переходит в работу
, полностью переходит в работу  .
.
На рис. 6 дан график зависимости идеального газа в циклическом процессе, состоящем из 1-2 ‑ изохорического процесса, 2-3 ‑ изотермического процесса и 3-1 – изобарического процесса.
На рис. 7 дан вид произвольного замкнутого цикла в координатах  . На графике можно выделить следующие работы.
. На графике можно выделить следующие работы.
1. Работа на верхнем участке 1-2. Эта работа равна всей площади по кривой  и положительна (объём увеличивается). Она равна количеству тепла
и положительна (объём увеличивается). Она равна количеству тепла 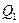 , поданного в систему.
, поданного в систему.
2. Работа на нижнем участке равна количеству тепла  , отнятого у системы, поскольку её надо вернуть в начальное состояние.
, отнятого у системы, поскольку её надо вернуть в начальное состояние.
3. Таким образом, суммарная работа за цикл, иначе её называют полезной, равна 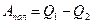 и при любых замкнутых процессах равна площади контура, изображающего цикл.
и при любых замкнутых процессах равна площади контура, изображающего цикл.
4. Общепринято использовать не  , а
, а  , т.е. нормированную на полную теплоту, поданную в систему. Это отношение
, т.е. нормированную на полную теплоту, поданную в систему. Это отношение

называют коэффициентом полезного действия.
Реализация замкнутого цикла возможна в конструкции, состоящей из теплоотдающего устройства (нагреватель) – оно передаёт рабочему телу (термодинамической системе) количество теплоты 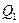 , теплозабирающего устройства (холодильника) – оно забирает у рабочего тела количество теплоты
, теплозабирающего устройства (холодильника) – оно забирает у рабочего тела количество теплоты  . При этом рабочим телом совершается работа
. При этом рабочим телом совершается работа  , которая, как мера передачи энергии, с помощью соответствующих конструкций переходит в другие виды энергий, например, в механическую, которая вызывает механические движения.
, которая, как мера передачи энергии, с помощью соответствующих конструкций переходит в другие виды энергий, например, в механическую, которая вызывает механические движения.
5. Фундаментальным циклом является цикл Карно, состоящий из двух адиабатных и двух изотермических процессов (рис.). Фундаментальность цикла Карно обусловлена тем, что:
1) к.п.д. цикла Карно может быть выражено непосредственно через температуры нагревателя ( ) и холодильника (
) и холодильника ( );
);
2) среди всех тепловых машин с данными температурами нагревателя  и холодильника
и холодильника  он обладает максимальным к.п.д., причём к.п.д. не зависит от свойств рабочего вещества
он обладает максимальным к.п.д., причём к.п.д. не зависит от свойств рабочего вещества
 ;
;
3) обладает свойством обратимости, т.е. может быть использован при расчёте холодильных машин.
Не нашли, что искали? Воспользуйтесь поиском: