
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Кристаллические тела
Кристаллические тела имеют кристаллическую решетку, упорядоченную структуру (дальний порядок).
Для кристаллическиз соединений характерны следующие свойства:
а) однородность строения (регулярная кристаллическая решетка).
б) анизотропия. Такие свойства как теплопроводность, электропроводность, твёрдость и т.д. неодинаковы в разных направлениях.
в) симметричность.
По симметрии выделяют различные типы решетки. Ниже приведены основные типы решеток.




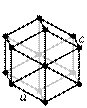
объемоцентричная гранецентрическая базоцентрическая примитивная гексагональная
В зависимости от того что находится в узлах решетки кристаллические решетки подразделяют на:
1. Ионные
2. Атомарные
3. Молекулярные
4. Металлические.
Ионные решетки
Кристаллические решетки, в узлах которых находятся ионы, называются ионными. В качестве иона могут выступать как одноатомные (Na+, Ca2+, Cl-), так и многоатомные ионы (SO42-, CO32). Каждый ион окружен противоионами. Число таких соседей называется координационным числом.
Связь удерживающие ионы в узлах решетки – электростатическая. обычно ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается.
Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Атомные решетки
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы углерод, кремний и др. имеют такие кристаллические решетки. Нередко соединения оксидов также образуют атомные кристаллы (например, диоксид кремния, оксида алюминия, оксида хрома).
Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами. Они очень прочные и твердые, плохо проводят теплоту и электричество. Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах. Они практически нерастворимы в каких-либо растворителях. Для них характерна низкая реакционная способность.
Некоторые атомы в узлах решетки могут замещаться на атомы сходные по размеру. Это явление называется сокристаллизацией (изоморфизм). В зависимости от примесей могут изменяться свойства кристаллов. Оксид алюминия может формировать корунд, рубин ( ионы хрома придают красную окраску) и сапфир ионы железа и титана придают синюю окраску).
В кристаллах алюмокалиевых квасцов KAl(SO4)2 . 12H2O катионы калия могут быть частично или полностью заменены катионами рубидия или аммония, а катионы алюминия - катионами хрома(III) или железа(III). Изоморфизм широко распространен в природе. Большинство минералов представляет собой изоморфные смеси сложного переменного состава.
Полиморфизм
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение, т. е. изменять тип элементарной ячейки своей кристаллической решетки. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
Процесс перехода одной модификации в другую может быть обратимым или необратимым. Так, при нагревании белого мягкого графитоподобного вещества состава BN (нитрид бора) при 1500-1800oС и давлении в несколько десятков атмосфер образуется его высокотемпературная модификация - боразон, по твердости близкий к алмазу. При понижении температуры и давления до значений, отвечающих обычным условиям, боразон сохраняет свою структуру. Примером обратимого перехода может служить взаимные превращения двух модификаций серы (ромбической и моноклинной) при 95о.С.
Полиморфные превращения могут проходить и без существенного изменения структуры. Иногда изменение кристаллической структуры вообще отсутствует, например, при переходе α-Fe в β-Fe при 769оС структура железа не меняется, однако исчезают его ферромагнитные свойства.Некоторые вещества имеют более двух полиморфных модификаций. Например, диоксид кремния имеет десять модификаций, фторид кальция - шесть, нитрат аммония - четыре.
Не нашли, что искали? Воспользуйтесь поиском: